
科目: 來源: 題型:
【題目】CH3COOH、H2CO3、H2SO3的電離常數如表所示。
酸 | 電離常數 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
請回答下列問題:
(1)①NaHSO3溶液中電荷守恒表達式_____。
②NaHSO3溶液中各離子濃度大小順序:_____。
(2)①用離子方程式表示Na2CO3溶液堿性的原因_____。
②寫出Na2CO3溶液中物料守恒表達式______。
③寫出NaHCO3溶液中質子守恒表達式______。
(3)常溫下,物質的量濃度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)從大到小排列順序為____(填序號)。
(4)常溫下,物質的量濃度均為0.1mol/L的六種溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH從大到小排列順序為____(填序號)。
(5)常溫時,AlCl3的水溶液呈酸性,原因是(用離子方程式表示):____,將AlCl3溶液蒸干,灼燒,最后得到的固體產物主要是____(填化學式)。
(6)證明CH3COOH是弱電解質的簡單且可行的方法是:_____。
(7)下列混合溶液中,各離子濃度的大小順序或等量關系正確的是____。
A.10 mL0.1mol/L氨水與10mL0.1mol/L鹽酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液與5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液與5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液與6mL1mol/L鹽酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO
查看答案和解析>>
科目: 來源: 題型:
【題目】科學家合成出了一種用于分離鑭系金屬的化合物 A,其結構如下圖所示。短周期元素 X、Y、Z原子序數依次增大,其中Z位于第三周期。Z與Y可以形成分子 ZY6,該分子常用作高壓電氣設備的絕緣介質。下列關于X、Y、Z的敘述,正確的是

A.化合物 A中,X、Y、Z最外層都達到8電子穩定結構
B.離子半徑:Y>Z
C.最簡單氫化物的沸點:Z>Y
D.最高價氧化物對應水化物的酸性:Z<X
查看答案和解析>>
科目: 來源: 題型:
【題目】鋅及其化合物用途廣泛。火法煉鋅以閃鋅礦(主要成分是ZnS)為主要原料,涉及的主要反應有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJmol-1
(1)反應ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____kJmol-1。
反應中生成的CO2與NH3混合,在一定條件下反應合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H。若該反應在一恒溫、恒容密閉容器內進行,判斷反應達到平衡狀態的標志是___。
CO(NH2)2(s)+H2O(g) △H。若該反應在一恒溫、恒容密閉容器內進行,判斷反應達到平衡狀態的標志是___。
a.CO2與H2O(g)濃度相等 b.容器中氣體的壓強不再改變
c.2v(NH3)正=v(H2O)逆 d.容器中混合氣體的密度不再改變
(2)亞硝酰氯(NOCl)是有機合成中的重要試劑,可由NO與Cl2在一定條件下合成:2NO(g)+Cl2(g)![]() 2NOCl(g) △H<0。保持恒溫恒容條件,將物質的量之和為3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]進行反應,平衡時某反應物的轉化率與氮氯比及不同溫度的關系如圖所示:
2NOCl(g) △H<0。保持恒溫恒容條件,將物質的量之和為3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]進行反應,平衡時某反應物的轉化率與氮氯比及不同溫度的關系如圖所示:
①圖中T1、T2的關系為:T1___T2(填“>”、“<”或“=”);
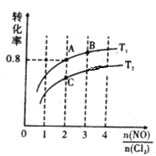
②圖中縱坐標為物質___的轉化率;
③圖中A、B、C三點對應的NOCl體積分數最大的是____(填“A”、“B”、或“C”);
④若容器容積為2L,則B點的平衡常數的值為____。
查看答案和解析>>
科目: 來源: 題型:
【題目】碳呼吸電池被譽為改變世界的創新技術,設想用碳呼吸電池為鋰硫電池充電的裝置如下圖所示,下列說法不正確的是
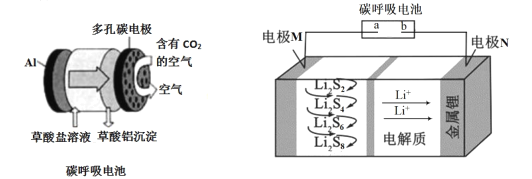
A.a極是多孔碳電極
B.充電時,外電路中流過0.02 mol電子,電極N質量增加0.14 g
C.隨著反應的進行,碳呼吸電池中C2O42- 數目不斷減小
D.充電時間越長,電池中的Li2S8量越多
查看答案和解析>>
科目: 來源: 題型:
【題目】設阿伏加德常數為NA,則下列說法正確的是( )
A.常溫常壓下,11.2LCH4中含有的氫原子數為2NA
B.標準狀況下,22.4 L二氧化硫中含有氧原子數為NA
C.2.7g鋁與足量的鹽酸反應,失去的電子數為0.3NA
D.1L0.1mol/L MgCl2溶液中含Mg2+數為0.2NA
查看答案和解析>>
科目: 來源: 題型:
【題目】已知NA表示阿伏加德羅常數的值,下列說法正確的是
A.標準狀況下,2.24 L CHCl3 所含共價鍵數為0.4NA
B.常溫常壓下,2 g羥基(18OD)所含的中子數為NA
C.常溫常壓下,1.5 g NO與1.6 g O2充分反應后混合物中原子總數為0.2NA
D.常溫下,2 L 0.1 molL-1FeCl3 溶液與1 L 0.2 molL-1FeCl3 溶液所含Fe3+數目相同
查看答案和解析>>
科目: 來源: 題型:
【題目】W、X、Y、Z是四種原子序數依次增大的短周期元素,W、X兩種元索可組成W2x和W2X2兩種常見的無色液體化合物, Y2X2為淡黃色固體化合物,Z的原子序數是X的原子序數的兩倍。請回答下列問題:
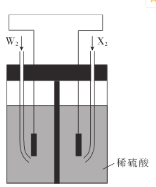
(1)Z元素的名稱是___________ 。
(2)W、X、Y三種元素形成的化合物的電子式_____________
(3)寫出Y2X2中所含化學鍵有:___________。
(4)寫出Y2X2和W2X反應的化學方程式:_______________
(5)W2和X2是組成某種燃料電池的兩種常見物質,如圖所示,通人X2的電極是___(填“正極”或“負極”),寫出通人W2的電極的電極反應式:________________
查看答案和解析>>
科目: 來源: 題型:
【題目】銥(Ir)和鋨(Os)屬于鉑族金屬,與金、銀合稱貴重金屬,可以用于電氣、精密儀表、催化劑等領域。銥鋨礦的主要成分有Ir、Os、Ir2O3、OsO2,還含有CuO和SiO2等雜質,從銥鋨礦中提取銥(Ir)和鋨(Os)的流程如下:
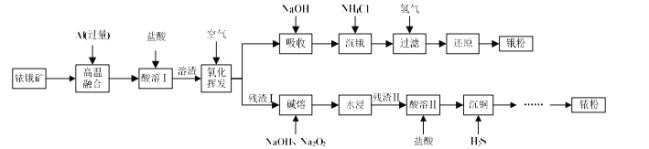
已知:①高溫融合發生反應的原理類似于鋁熱反應。
②四氧化鋨(OsO4)的熔點為41℃,易揮發、有惡臭和劇毒。
③四氨合二氧氯化鋨([OsO2(NH3)4]Cl2)呈淺黃色,難溶于有機物,微溶于水,能水解。
回答下列問題:
(1)“酸溶I”的目的是_____________________________________;酸溶I后溶渣的主要成分除Ir、Os外,還有_______ (填化學式)。
(2)“氧化揮發”是將溶渣置于300~800 ℃的管式爐內,通入空氣氧化。用NaOH溶液吸收OsO4生成Na2OsO4,該反應的離子方程式為 __________________;當吸收液質量增加59.5 g時,反應轉移電子的數目為 ______。
(3)“沉鋨”時, NH4Cl與Na2OsO4發生反應Na2OsO4 + 4NH4Cl=[OsO2(NH3)4]Cl2↓ + 2NaCl + 2H2O,該過程中NH4Cl需過量,目的是_____________________________ ;生成的鋨鹽要立即過濾,濾餅要經無水乙醇多次洗滌,用無水乙醇洗滌的原因是____。
(4)“殘渣I”的主要成分為Ir、CuO和SiO2。“堿熔”時,Ir與Na2O2反應生成IrO2·nNa2O和O2,該反應的化學方程式為 _______________________。
(5) “沉銅” 過程中,當通入H2S 達到飽和時測得溶液的pH=1,此時溶液中c(Cu2+)為____。[已知:25 ℃下,H2S溶于水形成飽和溶液時,c(H2S)=0.1mol/L;H2S的電離常數![]() ,
,![]() ;
;![]() ]
]
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,電離常數:
化學式 | CH3COOH | H2CO3 | HCN |
電離常數 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
請回答下列問題:
(1)物質的量濃度為0.1mol·L-1的下列四種物質:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的順序是____(填標號)。
(2)25℃時,在0.5mol·L-1的醋酸溶液中由醋酸電離出的c(H+)約是由水電離出的c(H+)的__倍。
(3)寫出向氰化鈉溶液中通入少量二氧化碳的離子方程式:______。
(4)25℃時,CH3COOH與CH3COONa的混合溶液,若測得混合液pH=6,則溶液中c(CH3COO-)-c(Na+)=___(填準確數值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃時,將amol·L-1的醋酸與bmol·L-1氫氧化鈉等體積混合,反應后溶液恰好顯中性,用a、b表示醋酸的電離常數為____。
(6)某溫度時,純水的pH=6。該溫度下0.01mol/LNaOH溶液的pH=___,向該溫度下的純水中加入少量的碳酸鈉固體,使溶液pH為9,則水電離出的c(OH-)=____。
查看答案和解析>>
科目: 來源: 題型:
【題目】化學反應原理對化學反應的研究具有指導意義。
(1)機動車廢氣排放已成為城市大氣污染的重要來源。
①氣缸中生成NO的反應為:N2(g)+O2(g)![]() 2NO(g)△H>0。汽車啟動后,氣缸內溫度越高,單位時間內NO排放量越大,請分析兩點原因。A_____;B______。
2NO(g)△H>0。汽車啟動后,氣缸內溫度越高,單位時間內NO排放量越大,請分析兩點原因。A_____;B______。
②汽車汽油不完全燃燒時還產生CO,若設想按下列反應除去CO:2CO(g)=2C(s)+O2(g) △H>0,該設想能否實現?____(選填“能”或“不能”),依據是____。
(2)一定條件下,Fe3+和I﹣在水溶液中的反應是2I﹣+2Fe3+![]() I2+2Fe2+,當反應達到平衡后,加入CCl4充分振蕩,且溫度不變,上述平衡向____(選填“正反應”或“逆反應”)方向移動。請設計一種使該反應的化學平衡逆向移動的簡單的實驗方案____。
I2+2Fe2+,當反應達到平衡后,加入CCl4充分振蕩,且溫度不變,上述平衡向____(選填“正反應”或“逆反應”)方向移動。請設計一種使該反應的化學平衡逆向移動的簡單的實驗方案____。
(3)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
則下列敘述正確的是______
A.由上述熱化學方程式可知b>c
B.甲烷的燃燒熱為bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物質的量之比為1∶2,其完全燃燒生成CO2和H2O(l)時放出的熱量為QkJ,則該混合物中甲醇的物質的量為![]() mol
mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com