
科目: 來源: 題型:
【題目】化學與生產、生活等密切相關,從化學視角回答下列問題:
(1)電閃雷鳴的雨天,空氣中發生的化學反應會增加雨水的含氮量,有關反應的化學方程式是_____、_______、_________________。
(2)我國以煤炭為主的能源結構決定了我國的酸雨以硫酸型為主,為減少SO2的污染和酸雨的形成,目前常應用石灰法脫硫。過程如下:通過煅燒石灰石得到生石灰,以生石灰為脫硫劑,在吸收塔中與廢氣中的SO2反應而將硫固定,最終生成CaSO4,有關反應的化學方程式為_______、______、_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】體NH4Br置于密閉容器中,在某溫度下,發生反應:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,測知H2的濃度為0.5 mol·L-1,HBr的濃度為4 mol·L-1,若上述反應速率用v(NH3)表示,則下列速率正確的是( )
Br2(g)+H2(g),2 min后,測知H2的濃度為0.5 mol·L-1,HBr的濃度為4 mol·L-1,若上述反應速率用v(NH3)表示,則下列速率正確的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室中某此氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置),用此裝置和相關試劑不能制取的氣體是( )
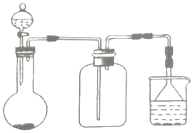
A.NH3B.SO2C.NO2D.Cl2
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:830℃,在一個密閉容器中發生反應:CO(g)+H2O(g) ![]() CO2(g)+H2(g),平衡常數K=1。某時刻測得容器內各物質的量分別為1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此時正、逆反應速率的大小關系為:
CO2(g)+H2(g),平衡常數K=1。某時刻測得容器內各物質的量分別為1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此時正、逆反應速率的大小關系為:
A. v正= v逆B. v正> v逆C. v正< v逆D. 無法確定
查看答案和解析>>
科目: 來源: 題型:
【題目】2019年諾貝爾化學獎頒給了三位為鋰離子電池發展作出重要貢獻的科學家。LiCoO2是鋰離子電池最早使用的電極材料,利用原鈷礦(主要成分為Co2O3)制備LiCoO2的工藝流程如圖:
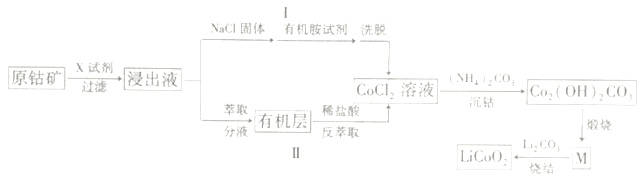
資料:在含一定量Cl-的溶液中,Co2+以CoCl42-形式存在:Co2++4C1-![]() CoCl42-
CoCl42-
(1)若“X試劑”是稀H2SO4和H2O2,則H2O2的作用是___。
(2)若“X試劑”是鹽酸,寫出離子反應方程式___。
(3)途徑I中加入NaCl固體的目的___(用平衡移動原理解釋)。
(4)“沉鈷”過程中,為了提高Co2(OH)2CO3的產量,溫度不宜過高的原因是___。
(5)已知M是鈷的某種氧化物,63.6gCo2(OH)2CO3,煅燒成物質M時轉移電子0.4mol,則M的化學式為___;寫出“燒結”的化學方程式___。
(6)取mg樣品溶于稀硫酸,加入過量KI溶液,再用cmol·L-1Na2S2O3標準液滴定(淀粉溶液做指示劑),達到滴定終點時,消耗Na2S2O3溶液VmL,則產品中鉆元素的百分含量為___。
(有關反應:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-=S4O62-+2I-)
查看答案和解析>>
科目: 來源: 題型:
【題目】I.下列物質:①氫氧化鈉溶液、②鋁片、③液態HCl 、④葡萄糖、⑤熔融的NaCl、⑥SO2 氣體、⑦碳酸氫鈉、 ⑧氧化鋁
(1)屬于電解質的是______________________。(填編號)
(2)能導電的是____________________________________。(填編號)
(3)①和②反應的離子方程式________________________________。
II.實驗室可通過K2Cr2O7溶液測定補鐵劑中FeSO4的含量,反應如下K2Cr2O7 +□FeSO4 +□H2SO4 =□Cr2(SO4)3+□Fe2(SO4)3+□K2SO4+□H2O
(1)配平上述方程式,并在方程式上面用“雙線橋”標明電子轉移的方向和數目。_______________
(2)該反應的還原產物為__________。若反應中消耗1 mol K2Cr2O7,則轉移電子數為______。
查看答案和解析>>
科目: 來源: 題型:
【題目】向100 mL1.5 mol/L的氫氧化鈉溶液中緩慢通入一定量的CO2,反應后,向所得溶液中逐滴緩慢滴加一定濃度的鹽酸,所得氣體的體積與所加鹽酸的體積(不考慮氣體溶解于水)關系如圖所示。下列說法錯誤的是
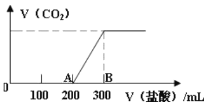
A.氫氧化鈉溶液與一定量的CO2充分反應后的溶液中溶質為Na2CO3和NaHCO3
B.鹽酸的濃度為0.5 mol/L
C.B點產生的氣體在標準狀況下體積1.12 L
D.AB段發生反應的離子方程式為:HCO3- + H+ = H2O+ CO2↑
查看答案和解析>>
科目: 來源: 題型:
【題目】光刻膠(I)是半導體制造的一種重要材料,其中一種合成路線如下,完成下列填空。
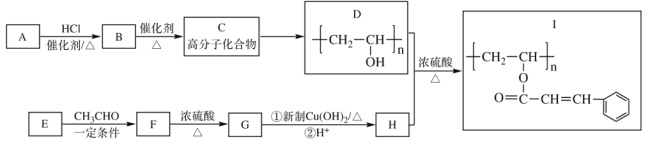
已知:![]()
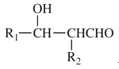
(1)A的電子式_____________,E的結構簡式_____________;
(2)C→D反應的試劑和條件為_____________,F→G的反應類型_____________;
(3)D+H→I的化學反應方程式___________________________________________;
(4)H的芳香類同分異構體中,可以發生水解反應和銀鏡反應的有_________種;
(5)![]() 是重要的工業加工助劑,寫出以乙烯和乙醛為原料制備
是重要的工業加工助劑,寫出以乙烯和乙醛為原料制備![]() 的合成路線。(其它無機試劑任選),(合成路線常用的表達方式為:A
的合成路線。(其它無機試劑任選),(合成路線常用的表達方式為:A B
B 目標產物)___________________
目標產物)___________________
查看答案和解析>>
科目: 來源: 題型:
【題目】某實驗小組同學為了測定工業純堿的純度,進行了一系列實驗。
(1)和索氏制堿法相比,侯氏制堿法的優勢有___________________________________;
(2)工業純堿中常含有少量NaCl雜質,解釋原因__________________________,檢驗是否含有氯化鈉雜質的方法為__________________________________________________________;
(3)使用重量法測定純堿的純度,用到的試劑有__________________________________;
(4)使用滴定法測定純堿的純度,用_________________(填儀器名稱)稱量1.200g工業純堿樣品,溶解,用1mol/L鹽酸做標準液,滴定過程中溶液pH變化和生成CO2的量如圖所示,A點溶液呈堿性的原因______________________________________________________,計算該工業純堿樣品的質量分數_______________。(計算結果保留兩位小數)
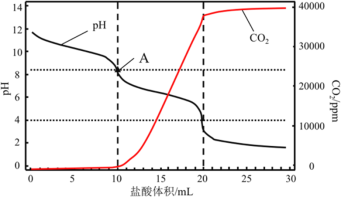 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】硫及其化合物與人類生產、生活密切相關。
(1)已知:S(s)+O2(g)= SO2(g) ΔH1=-a kJ·mol-1
S(g)+O2(g)= SO2(g) ΔH2=- b kJ·mol-1
則a___(填“>”或“<”)b。
(2)在一定溫度和壓強下,將2molSO2和1molO2置于密閉容器中發生反應:2SO2(g)+O2(g)![]() 2SO3(g),并達到平衡。
2SO3(g),并達到平衡。
①若再加入1 molO2,該平衡向___(填“正”或“逆”)反應方向移動;
②若降低溫度,達到平衡時測得SO2的含量減少,則正反應是___(填“吸熱”或“放熱”)反應;
③該反應的化學平衡常數表達式K=___。若只增大壓強,則K__(填“增大”“減小”或“不變”)。
(3)常溫下,現有0.5mol·L-1Na2SO3溶液,請判斷:(Na2SO3第一步水解的離子方程式是SO32-+H2O![]() HSO3-+OH-)
HSO3-+OH-)
①該溶液的pH___(填“>”或“<”)7;
②該溶液中c(Na+)___(填“>”或“<”)2c(SO32-);
③鹽類水解反應是吸熱反應。加熱該溶液,SO32-的濃度將__(填“增大”或“減小”)。
(4)如圖是電解硫酸銅溶液的裝置。
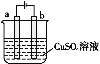
①若a、b為石墨電極,b電極的質量增加,寫出該極的電極反應式:___;
②電鍍是電解原理的一種重要應用。若利用該裝置在鐵件上鍍銅,則鐵件應與電源的__ (填“正極”或“負極”)連接。
(5)已知硫酸鋇的沉淀溶解平衡為:BaSO4(s)![]() Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸鋇的飽和溶液中Ba2+的濃度為____mol·L-1。
Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸鋇的飽和溶液中Ba2+的濃度為____mol·L-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com