
科目: 來源: 題型:
【題目】通過對陽極泥的綜合處理可以回收貴重的金屬,一種從銅陽極泥(主要成分為Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分離Ag、Se和Cu的新工藝流程如圖所示:
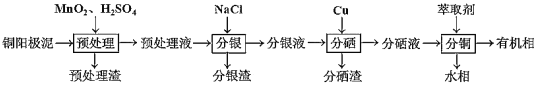
(1)已知預處理溫度為80℃,預處理渣中幾乎不含S元素,預處理時Cu2S發生反應的離子方程式為___,比起傳統工藝中采用濃硫酸作氧化劑,本工藝中采用稀H2SO4溶液添加MnO2做預處理劑的主要優點是___。
(2)回收分渣中的銀,可用如下過程:
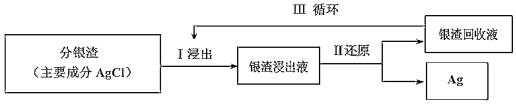
已知:S2O32-在堿性條件下很穩定,易與銀離子絡合:Ag++2S2O32-![]() Ag(S2O3)23-。常溫下,絡合反應的平衡常數為K穩[Ag(S2O3)23-]=2.8×1013,Ksp(AgCl)=1.8×10-10。
Ag(S2O3)23-。常溫下,絡合反應的平衡常數為K穩[Ag(S2O3)23-]=2.8×1013,Ksp(AgCl)=1.8×10-10。
①Ⅰ中發生的離子反應方程式為:AgCl(s)+2S2O32-(aq)![]() Ag(S2O3)23-(aq)+Cl-(aq),常溫下此反應的平衡常數K為___(結果保留二位小數)。
Ag(S2O3)23-(aq)+Cl-(aq),常溫下此反應的平衡常數K為___(結果保留二位小數)。
②Ⅱ中還原劑為Na2S2O4,在堿性條件下進行反應生成Na2SO3,相應的離子反應方程式為:2Ag(S2O3)23-+S2O42-+4OH-=2Ag+4S2O32-+2SO32-+2H2O,所以Ⅲ中的銀渣回收液可直接循環使用,但循環多次后銀的浸出率會降低,請從化學平衡移動的角度分析原因___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亞硒酸(H2SeO3)。
①已知常溫下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-4,則NaHSeO3溶液的pH__7(填“>”、“<”或“=”)。
②二元強酸硒酸(H2SeO4)可以用電解亞硒酸溶液的方法制得,電解時的陽極反應式為___。
(4)分銅得到產品CuSO45H2O的具體操作如下:
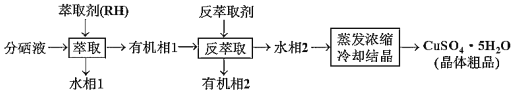
①萃取與反萃取原理為:2RH+Cu2+![]() R2Cu+2H+,反萃取劑最好選用__(填化學式)溶液。
R2Cu+2H+,反萃取劑最好選用__(填化學式)溶液。
②蒸發濃縮需用小火加熱至溶液表面出現__為止,再冷卻結晶即可得到產品CuSO45H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】由SO2和O2制備SO3(熔點16.8℃,沸點44.8℃)的模擬裝置如下圖所示)(加熱和夾持裝置省略):

下列說法正確的是
A. 裝置①中的試劑為飽和NaHSO3溶液
B. 實驗室可用銅與稀硫酸在加熱條件下制取SO2
C. 裝置③反應管中的鉑石棉用作反應的催化劑
D. 從裝置⑤逸出的氣體有過量的SO2和O2
查看答案和解析>>
科目: 來源: 題型:
【題目】喹啉是合成藥物的中間體,一種合成喹啉的路線如圖:

(1)A→B所需的試劑為_____。
(2)兩分子B在一定條件下生成C和乙醇,化合物B斷鍵的位置為_____(填序號)
(3)C→D的反應類型為_____,D→E的反應方程式是_____。
(4)化合物G中,除亞氨基外還含有的官能團名稱是_____。
(5)F的同分異構體W能與碳酸氫鈉溶液反應放出氣體,且能使溴水褪色,其中核磁共振氫譜峰面積比為6:1:1。W的結構簡式為_____。
(6)參照上述路線,設計以苯胺(![]() )和
)和 制備的
制備的 合成路線(無機試劑任選)_____。
合成路線(無機試劑任選)_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知異丁烷的分子結構可簡寫成鍵線式結構為![]() 。有機物X的鍵線式結構為
。有機物X的鍵線式結構為![]() ,有機物Y與等物質的量的H2發生加成反應可得到有機物X。下列有關說法錯誤的是( )
,有機物Y與等物質的量的H2發生加成反應可得到有機物X。下列有關說法錯誤的是( )
A. 有機物X的一氯代物只有4種
B. 用系統命名法命名有機物X名稱為2,2,3-三甲基戊烷
C. 有機物X的分子式為C8H18
D. Y的結構可能有3種,其中一種名稱為3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是( )
A. 常溫常壓下,15g甲基(-CH3)所含的電子數為10NA
B. 常溫常壓,11.2L氦氣中含有的原子數為0.5NA
C. 標準狀況下,4.48L重水(D2O)中含有的中子數為2NA
D. 常溫常壓下,23gNO2和N2O4的混合物中含有NA個氧原子
查看答案和解析>>
科目: 來源: 題型:
【題目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的幾種。①若加入鋅粒,產生無色無味的氣體;②若加入NaOH溶液,產生白色沉淀,且產生的沉淀量與加入NaOH的物質的量之間的關系如圖所示。則下列說法正確的是
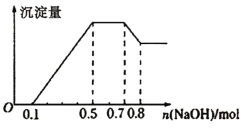
A.溶液中的陽離子只有H+、Mg2+、Al3+
B.溶液中一定不含CO32-和SO42-,可能含有Cl-
C.溶液中n(Mg2+)=0.1mol
D.n(H+) :n(NH4+) : n(Al3+) : n(Mg2+)=2:4:2:1
查看答案和解析>>
科目: 來源: 題型:
【題目】鋁是應用廣泛的金屬。以鋁土礦(主要成分為Al2O3,含SiO2和Fe2O3等雜質)為原料制備鋁的一種工藝流程如下:

注:SiO2在“堿溶”時轉化為鋁硅酸鈉沉淀。
(1)“堿溶”時生成偏鋁酸鈉的離子方程式為_____________________。
(2)向“過濾Ⅰ”所得濾液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不變”或“減小”)。
(3)“電解Ⅰ”是電解熔融Al2O3,電解過程中作陽極的石墨易消耗,原因是___________。
(4)“電解Ⅱ”是電解Na2CO3溶液,原理如圖所示。陽極的電極反應式為_____________________,陰極產生的物質A的化學式為____________。

(5)鋁粉在1000℃時可與N2反應制備AlN。在鋁粉中添加少量NH4Cl固體并充分混合,有利于AlN的制備,其主要原因是_____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】Cu2S是火法煉銅的重要原料之一,如圖是由Cu2S冶煉銅及制取CuSO4·5H2O的流程圖。
Cu2S![]() Cu
Cu![]() Cu2O、CuO
Cu2O、CuO![]() A
A![]() B
B![]() 膽礬
膽礬
(1)Cu2S中銅元素的化合價為___,火法煉銅的反應原理是__________(用化學方程式表示)。
(2)向Cu2O、CuO中加入足量稀硫酸得到的體系A中溶液呈藍色,且有紅色物質生成,請寫出生成紅色物質的離子方程式____________。
(3)若將A中紅色物質反應掉,操作Ⅰ中加入的試劑最好是___(填字母序號)。
A.適量的NaNO3
B.適量的HNO3
C.適量的H2O2
(4)若B溶液的體積為0.2L,電解B溶液一段時間后溶液的pH由2變為1(體積變化忽略不計),此時電解過程中轉移電子的物質的量是_____。
(5)取5.0g膽礬樣品逐漸升高溫度使其分解,分解過程的熱重曲線如圖所示。通過計算確定258℃時發生反應的化學方程式:____,e點對應物質的化學式為_____(計算過程略去)。

查看答案和解析>>
科目: 來源: 題型:
【題目】緒(Ge)是半導體元素,應用廣泛,回答下列問題:
(1)下列為Ge價電子層電子排布圖表示的狀態中,能量最低和最高的分別為____、_____(填選項)。
A.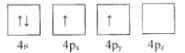 B.
B.
C.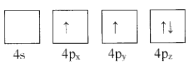 D.
D.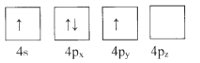
(2)GeH4的空間構型為____;比較與同鍺族的氫化物的沸點如表所示,分析其變化規律及原因____。
CH4 | SiH4 | GeH4 | |
沸點/℃ | -161.5 | -119 | -88.1 |
(3)有機鍺化合物A有一定的醫療保健作用,其結構簡式為CF3N=GeH2,則Ge的雜化形式為____,碳原子與其它原子結合的鍵的種類為_____。
(4)Li2GeF6可以作為鋰電池的電解質,則Li、Ge、F電負性由大到小的順序為_____。
(5)Ge晶胞如下,其中原子坐標參數A為(0,0,0);B為(![]() ,0,
,0,![]() ),D為(
),D為(![]() ,
,![]() ,
,![]() )。則C原子的坐標參數為_____。
)。則C原子的坐標參數為_____。
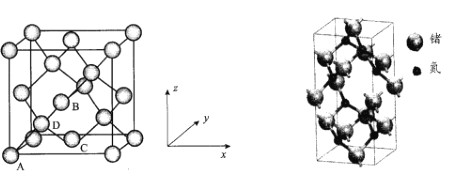
(6)氮化鍺具有耐腐蝕、硬度高等優點,晶體中鍺原子與氮原子之間存在明顯的s-p雜化現象,氮化鍺晶體屬于____晶體。一種氮化鍺晶胞的球棍模型如圖,晶體中n(Ge)/n(N)=____,若晶胞底面正方形的邊長為anm,阿伏加德羅常數值為NA,晶體的密度為ρg/cm3,則長方體的高為____nm(列出計算式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】CO2加氫可轉化為高附加值的CO、CH4、CH3OH等C1產物。該過程可緩解CO2帶來的環境壓力,同時可變廢為寶,帶來巨大的經濟效益。CO2加氫過程,主要發生的三個競爭反應為:
反應i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.01kJmol-1
CH3OH(g)+H2O(g)△H=-49.01kJmol-1
反應ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
反應iii:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.17kJmol-1
CO(g)+H2O(g)△H=+41.17kJmol-1
回答下列問題:
(1)由CO、H2合成甲醇的熱化學方程式為_____。
(2)反應iii為逆水煤氣變換反應,簡稱RWGS。以金屬催化劑為例,該反應歷程的微觀示意和相對能量(eV)變化圖如圖所示(![]() 為催化劑,
為催化劑,![]() 為C原子,
為C原子,![]() 為O原子,o為H原子)
為O原子,o為H原子)
歷程I:

歷程II:
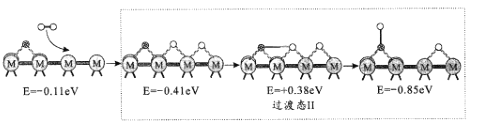
歷程III:
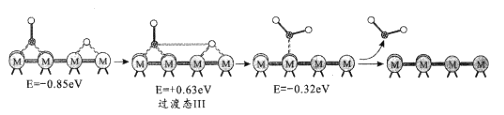
①歷程1方框內反應的方程式為CO2*+*=CO*+O*(*為催化劑活性位點)。根據圖示,其反應熱△H_____0(填“>”或“<”)。
②反應歷程II方框內的方程式是_____。
③反應歷程中_____(填“歷程I”、“歷程II”或“歷程III”)是RWGS的控速步驟。
(3)我國科學家研究了不同反應溫度對含碳產組成的影響。在反應器中按 =3:1通入H2和CO2,分別在0.1MPa和1MPa下進行反應。試驗中溫度對平衡組成C1(CO2、CO、CH4)中的CO和CH4的影響如圖所示(該反應條件下甲醇產量極低,因此忽略“反應i”):
=3:1通入H2和CO2,分別在0.1MPa和1MPa下進行反應。試驗中溫度對平衡組成C1(CO2、CO、CH4)中的CO和CH4的影響如圖所示(該反應條件下甲醇產量極低,因此忽略“反應i”):

①1MPa時,表示CH4和CO平衡組成隨溫度變化關系的曲線分別是_____、_____。M點CO平衡組成含量高于N點的原因是_____。
②當CH4和CO平衡組成為40%時,該溫度下反應iii的平衡常數Kp為_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com