
科目: 來源: 題型:
【題目】不同條件下,用O2氧化a mol/L FeCl2溶液過程中所測的實驗數據如圖所示。下列分析或推測合理的是
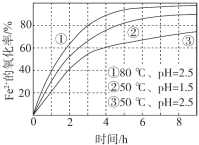
A. 由①、②可知, pH越大,+2價鐵越易被氧化
B. 由②、③推測,若pH>7,+2價鐵更難被氧化
C. 由①、③推測,FeCl2被O2氧化的反應為放熱反應
D. 60℃、pH=2.5時, 4 h內Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組探究Br2、I2能否將Fe2+氧化,實驗如下。
實驗 | 試劑x | 現象及操作 |
| 溴水 | i.溶液呈黃色,取出少量滴加KSCN溶液,變紅 |
碘水 | ii.溶液呈黃色,取出少量滴加KSCN溶液,未變紅 |
(1)實驗ⅰ中產生Fe3+ 的離子方程式是________。
(2)以上實驗體現出氧化性關系:Br2_______I2(填“>”或“<”)。
(3)針對實驗ⅱ中未檢測到Fe3+,小組同學I2 +2Fe2+ ![]() 2Fe3+ + 2I-(反應a),限度小,產生的c(Fe3+)低;若向ⅱ的黃色溶液中加入AgNO3溶液,可產生黃色沉淀,平衡向_____移動,c(Fe3+)增大。
2Fe3+ + 2I-(反應a),限度小,產生的c(Fe3+)低;若向ⅱ的黃色溶液中加入AgNO3溶液,可產生黃色沉淀,平衡向_____移動,c(Fe3+)增大。
(4)針對小組同學的分析,進行實驗ⅲ:向ⅱ的黃色溶液中滴加足量AgNO3溶液。現象及操作如下:
Ⅰ.立即產生黃色沉淀,一段時間后,又有黑色固體從溶液中析出;取出少量黑色固體,洗滌后,_________(填操作和現象),證明黑色固體含有Ag。
Ⅱ.靜置,取上層溶液,用KSCN溶液檢驗,變紅;用CCl4萃取,無明顯現象。
(5)針對上述現象,小組同學提出不同觀點并對之進行研究。
① 觀點1:由產生黃色沉淀不能判斷反應a的平衡正向移動,說明理由:______。經證實觀點1合理。
② 觀點2:Fe3+ 可能由Ag+ 氧化產生。
實驗ⅳ:向FeSO4溶液滴加AgNO3溶液,_____(填現象、操作),觀點2合理。
(6)觀點1、2雖然合理,但加入AgNO3溶液能否使反應a的平衡移動,還需要進一步確認。設計實驗:取ⅱ的黃色溶液,______(填操作、現象)。由此得出結論:不能充分說明(4)中產生Fe3+的原因是由反應a的平衡移動造成的。
查看答案和解析>>
科目: 來源: 題型:
【題目】含+6價鉻的廢水毒性強,對環境污染嚴重。化工廠常用SO2處理含鉻廢水,其工藝流程如下圖所示:
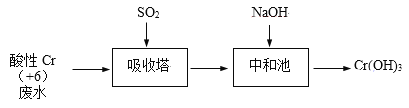
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
(1)將吸收塔中1mol Cr2O72-與SO2反應的熱化學方程式補全。
Cr2O72-(aq) + __SO2(g) + ___ ___ + ___ +___ ΔH = -1145 kJ/mol
(2)其他條件不變,研究吸收塔中pH對反應的影響。
pH | 2 | 4 | 6 |
Cr(+6) 最大去除率 | 99.99% 達排放標準 | 99.95% 達排放標準 | 99.5% 未達排放標準 |
時間 | 30 min | 35 min | 45 min |
①由上述數據獲得的結論有________。
②實際工業生產控制pH = 4左右的原因是________。
③下列說法不合理的是________。
a.該酸性含鉻廢水中一定含有CrO42-,pH越大其含量越高
b.其他條件不變,增大壓強,吸收塔中反應的K增大,有利于除去Cr(+6)
c.理論上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(3)其他條件不變,研究溫度對Cr(+6)去除率的影響(如圖1所示)。
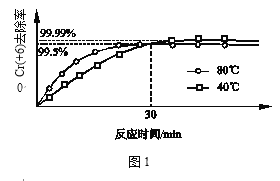
30min前相同時間內,80℃的Cr(+6)去除率比40℃高,30min后80℃的Cr(+6)去除率低,原因分別是_______;_______。
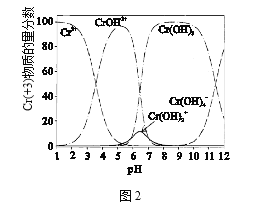
(4)圖2為Cr(+3)微粒物質的量分數隨溶液pH的變化關系示意圖,中和池中應控制pH范圍為_________。
(5)廢水中Cr(+6)總濃度為a×10-3 mol/L,處理1000 L廢水,去除率要求達到99.95%,理論上需要SO2物質的量為_________mol(寫計算式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】草酸亞鐵晶體(FeC2O4·2H2O,相對分子質量為180)呈淡黃色,可用作照相顯影劑。某實驗小組對其進行了一系列探究。
I.純凈草酸亞鐵晶體熱分解產物的探究。
(1)氣體產物成分的探究。小組成員采用如下裝置(可重復選用)進行實驗:

①裝置D的名稱為___________。
②按照氣流從左到右的方向,上述裝置的連接順序為___________→尾氣處理裝置(填儀器接口的字母編號)。
③實驗前先通入一段時間N2,其目的為______________________。
④實驗證明了氣體產物中含有CO,依據的實驗現象為______________________。
(2)固體產物成分的探究。充分反應后,A處反應管中殘留黑色固體。查閱資料可知,黑色固體可能為Fe或FeO。小組成員設計實驗證明了其成分只有FeO,其操作及現象為___________。
(3)依據(1)和(2)結論,可知A處反應管中發生反應的化學方程式為___________。
Ⅱ.草酸亞鐵晶體樣品純度的測定
工業制得的草酸亞鐵晶體中常含有FeSO4雜質,測定其純度的步驟如下:
步驟1:稱取m g草酸亞鐵晶體樣品并溶于稀H2SO4中,配成250mL溶液。
步驟2:取上述溶液25.00mL,用c mol· L -1KMnO4標準液滴定至終點,消耗標準液V1mL;
步驟3:向反應后溶液中加入適量鋅粉,充分反應后,加入適量稀H2SO4,再用cmol·L-1KMnO4標準溶液滴定至終點,消耗標準液V2mL。
(4)步驟3中加入鋅粉的目的為____________________________________________。
(5)草酸亞鐵晶體樣品的純度為____________________________________________;若步驟1配制溶液時部分Fe2+被氧化,則測定結果將___________(填“偏高”、“偏低”或“不變”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】BMO(Bi2MoO6)是一種高效光催化劑,可用于光催化降解苯酚,原理如圖所示。下列說法不正確的是

A. 該過程的總反應:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B. 該過程中BMO表現較強氧化性
C. 降解產物的分子中只含有極性共價鍵
D. ①和②中被降解的苯酚的物質的量之比為3:1
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)配平下列方程式,用雙線橋法表示出電子轉移的數目。 Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 + H2O ,____________,氧化劑 ________ ,氧化產物 __________
(2)用單線橋法表示下列氧化還原反應敀關系, 并標出電子轉移的數目。用MnO2氧化密度為1.19 g/cm3,溶質質量分數為36.5%的HCl溶液,反應得到澄清溶液。反應的化學方程式為: MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①該反應的離子方程式為: _____________________________________________,該鹽酸的物質的量濃度為___________mol/L。
②氧化劑與還原劑物質的量之比為_______________
③8.7gMnO2與足量濃鹽酸反應能使________molHCl被氧化;其中,還原過程為:________→_______,__________。
④如果該反應轉移1mol電子,則生成標準狀況下的氣體體積為___________L。
查看答案和解析>>
科目: 來源: 題型:
【題目】8.8g FeS與400mL 1 mol/L硝酸溶液恰好完全反應,反應后產物為Fe2(SO4)3和Fe(NO3)3, X、H2O,則X為( )
A.N2B.NOC.N2OD.NO2
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法錯誤的是
A. 2H2S+SO2=3S↓+2H2O中,氧化產物和還原產物物質的量之比為2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化劑和還原劑物質的量之比為5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被還原的碘原子物質的量之比為1:5
5KI+KIO3+3H2O中,被氧化和被還原的碘原子物質的量之比為1:5
D. 2FeS+6H2SO4(濃)![]() Fe2(SO4)3+3SO2↑+2S↓+6H2O中,發生氧化反應和發生還原反應的硫原子物質的量之比為2:3
Fe2(SO4)3+3SO2↑+2S↓+6H2O中,發生氧化反應和發生還原反應的硫原子物質的量之比為2:3
查看答案和解析>>
科目: 來源: 題型:
【題目】設 NA 表示阿伏加德羅常數的值,下列說法正確的是
A.標準狀況下,22.4L CCl4中含有的分子數為NA
B.1L 0.5 mol/LNa2SO4溶液中,含有的氧原子總數為2NA
C.0.5 mol/LFe2(SO4)3 溶液中,SO42-的數目為 1.5 NA
D.C2H4 和 C3H6 的混合物 ag,所含原子總數為![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】Fe3O4中含有![]() 、
、![]() ,分別表示為Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd為催化材料,可實現用H2消除酸性廢水中的致癌物NO2-,其反應過程示意圖如圖所示,下列說法不正確的是
,分別表示為Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd為催化材料,可實現用H2消除酸性廢水中的致癌物NO2-,其反應過程示意圖如圖所示,下列說法不正確的是

A. Pd上發生的電極反應為:H2 - 2e- 2H+
B. Fe(Ⅱ)與Fe(Ⅲ)的相互轉化起到了傳遞電子的作用
C. 反應過程中NO2-被Fe(Ⅱ)還原為N2
D. 用該法處理后水體的pH降低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com