
科目: 來源: 題型:
【題目】氧化還原反應在生產、生活中具有廣泛的用途,貫穿古今。
(1)水是人體的重要組成部分,是人體中含量最多的一種物質。而“四種基本反應類型與氧化還原
反應的關系”可用如圖表達。

試寫出有水參加的符合反應類型Ⅳ的一個化學方程式:_____________________________,其中水為________劑。
(2)氯化銨常用作焊接。如:在焊接銅器時用氯化銨除去銅器表面的氧化銅以便焊接,其反應為:___CuO+____NH4Cl ![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化還原反應方程式。
②該反應中,被氧化的元素是______(填元素名稱),氧化劑是________(填化學式)。
③反應中若產生0.2mol的氣體,則有________mol的電子轉移。
查看答案和解析>>
科目: 來源: 題型:
【題目】由SO2催化氧化制取SO3的裝置如圖所示,下列說法錯誤的是
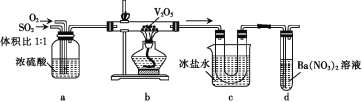
A.裝置a可干燥并混合SO2和O2
B.裝置b中流出的氣體有SO2、SO3及O2
C.裝置c中U形管內壁上有白色固體
D.裝置d中有白色沉淀,說明通入d的氣體中含SO3
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室可利用環己醇的氧化反應制備環己酮,反應原理和實驗裝置(部分夾持裝置略)如下:
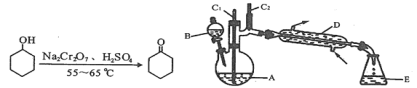
有關物質的物理性質見下表。
物質 | 沸點(℃) | 密度(g·cm-3,20℃) | 溶解性 |
環己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
環己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括號中的數據表示該有機物與水形成的具有固定組成的混合物的沸點。實驗中通過裝置B將酸性Na2Cr2O7溶液加到盛有10mL環己醇的A中,在55~60℃進行反應。反應完成后,加入適量水,蒸餾,收集95~100℃的餾分,得到主要含環己酮粗品和水的混合物。
(1)裝置D的名稱為____________________________。
(2)酸性Na2Cr2O7溶液氧化環己醇反應的△H<0,反應劇烈將導致體系溫度迅速上升,副反應增多。
①滴加酸性Na2Cr2O7溶液的操作為_______________;
②蒸餾不能分離環己酮和水的原因是______________。
(3)環己酮的提純需要經過以下一系列的操作:
a.往液體中加入NaCl固體至飽和,靜置,分液;
b.水層用乙醚(乙醚沸點34.6℃,易燃燒)萃取,萃取液并入有機層;
c.加人無水MgSO4固體,除去有機物中少量的水;
d.過濾;
e.蒸餾、除去乙醚后,收集151~156℃餾分。
①B中水層用乙醚萃取的目的是_________;
②上述操作a、d中使用的玻璃儀器除燒杯、錐形瓶、玻璃棒外,還需要的玻璃儀器有__,操作a中,加入NaC1固體的作用是____。
③恢復至室溫時,分離得到純產品體積為6mL,則環已酮的產率為_____。(計算結果精確到0.1%)
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關儀器的使用或實驗操作正確的是
A.用稀鹽酸洗滌H2還原CuO后試管內壁的銅
B.蒸發時,蒸發皿中溶液的量不能超過總容量的![]()
C.分離苯萃取溴水后的分層液體,從分液漏斗下口先放出水層,再放出有機層
D.用KMnO4溶液測定Na2C2O4的濃度時,KMnO4溶液盛放在堿式滴定管中
查看答案和解析>>
科目: 來源: 題型:
【題目】按要求答題。
(1) 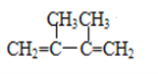 (命名)_____________________________________。
(命名)_____________________________________。
(2)  (指出所含官能團名稱)_____________________________________。
(指出所含官能團名稱)_____________________________________。
(3)寫出以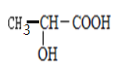 為單體發生縮聚反應的方程式________________________。
為單體發生縮聚反應的方程式________________________。
(4) 制TNT炸藥的反應________。
查看答案和解析>>
科目: 來源: 題型:
【題目】水熱法制備Fe3O4納米顆粒的總反應為:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列說法正確的是( )
A. 硫元素被氧化,鐵元素被還原
B. Fe2+、S2O32- 都是還原劑
C. X=2
D. 每生成1mol Fe3O4,則轉移電子數2mol
查看答案和解析>>
科目: 來源: 題型:
【題目】一種用于隱形眼鏡材料的聚合物片段如下:

下列關于該高分子說法正確的是
A. 結構簡式為:
B. 氫鍵對該高分子的性能沒有影響
C. 完全水解得到的高分子有機物,含有官能團羧基和碳碳雙鍵
D. 完全水解得到的小分子有機物,具有4種不同化學環境的氫原子
查看答案和解析>>
科目: 來源: 題型:
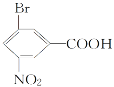
【題目】分枝酸可用于生化研究。其結構簡式如圖。下列關于分枝酸的敘述正確的是

A. 分子中含有2種官能團
B. 可與乙醇、乙酸反應,且反應類型相同
C. 1mol分枝酸最多可與3molNaOH發生中和反應
D. 可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同
查看答案和解析>>
科目: 來源: 題型:
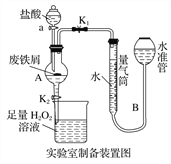
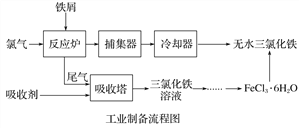
【題目】氯化鐵是常見的水處理劑,利用廢鐵屑可制備無水氯化鐵。實驗室制備裝置和工業制備流程圖如下:
已知:(1)無水FeCl3的熔點為555 K、沸點為588 K。
(2)廢鐵屑中的雜質不與鹽酸反應。
(3)不同溫度下六水合氯化鐵在水中的溶解度如下:
溫度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
實驗室制備操作步驟如下:
Ⅰ.打開彈簧夾K1,關閉活塞K2,并打開活塞a,緩慢滴加鹽酸;
Ⅱ.當……時,關閉彈簧夾K1,打開活塞K2,當A中溶液完全進入燒杯后關閉活塞a;
Ⅲ.將燒杯中溶液經過一系列操作后得到FeCl3·6H2O晶體。
請回答:
(1)燒杯中足量的H2O2溶液的作用是_____________________________。
(2)為了測定廢鐵屑中鐵的質量分數,操作Ⅱ中“…”的內容是______________。
(3)從FeCl3溶液制得FeCl3·6H2O晶體的操作步驟是加入______________后__________________、過濾、洗滌、干燥。
(4)試寫出吸收塔中反應的離子方程式:______________________。
(5)捕集器溫度超過673 K時,存在相對分子質量為325的鐵的氯化物,該物質的分子式(相對原子質量:Cl-35.5、Fe-56)為____________。
(6)FeCl3的質量分數通常可用碘量法測定:稱取m g無水氯化鐵樣品,溶于稀鹽酸,配制成100 mL溶液;取出10.00 mL,加入稍過量的KI溶液,充分反應后,滴入幾滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定終點的現象是________________________________________________;
②樣品中氯化鐵的質量分數為__________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com