
科目: 來源: 題型:
【題目】常溫下,向 20 mL 0.2 mol/LH2A溶液中滴加0. 2 mol/L NaOH溶液.有關微粒的物質的量變化曲線如圖所示(其中I代表H2A.,II代表HA—,III表A2—)。根據圖示.判斷下列說法正確的是

A.當V(NaOH)=20 mL時.溶液中各離子濃度的大小關系為c(Na+)>c(HA—)>c(H+)>c(A2一)>c(OH—)
B.等體積、等物質的量濃度的NaOH溶液與H2 A溶液混合后,其溶液中水的電離程度比純水中的大
C.NaHA溶液中:c(OH—)+2c(A2—) =c(H+) +c(H2A )
D.將Na2A溶液加水稀釋.溶液中所有離子的濃度都減小.但部分離子的物質的量增加
查看答案和解析>>
科目: 來源: 題型:
【題目】在密閉容器中的一定量混合氣體發生反應:![]() 平衡時測得A的濃度為0.50mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得A的濃度為0.30mol/L。下列有關判斷正確的是
平衡時測得A的濃度為0.50mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得A的濃度為0.30mol/L。下列有關判斷正確的是
A.x+y﹤zB.平衡向正反應方向移動
C.B的轉化率降低D.C的體積分數升高
查看答案和解析>>
科目: 來源: 題型:
【題目】下列表示對應化學反應的離子方程式正確的是()
A.NH4HCO3溶液與過量KOH濃溶液共熱:![]() + OH-
+ OH-![]() NH3↑+ H2O
NH3↑+ H2O
B.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好為中性: Ba2++ OH- + H+ +![]() = BaS04↓+ H2O
= BaS04↓+ H2O
C.醋酸鉛溶液通入硫化氫氣體的反應:Pb(CH3COO)2 + H2S = PbS + 2CH3COOH
D.向NaAlO2溶液中通入過量CO2:2![]() + CO2 + 3H2O = 2Al(OH)3↓+
+ CO2 + 3H2O = 2Al(OH)3↓+ ![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】SO2、NO是大氣污染物,NH4NO3、H2SO4等是水體污染物,有效去除這些污染物是一項重要課題。
(1)NO、SO2可以先氧化,后用堿吸收。其氧化過程的反應原理如下:
NO(g)+O3(g)NO2(g)+O2(g) H1=-200.9kJ/mol
SO2(g)+O3(g) SO3(g)+O2(g) H2=-241.6kJ/mol
2SO2(g)+O2(g) 2SO3(g) H3=-196.6kJ/mol
則反應2NO2(g) 2NO(g)+O2(g)的H=___kJ/mol
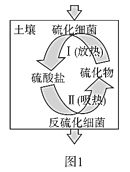
(2)土壤中的硫循環如圖1所示。
①土壤中的黃鐵礦(FeS2)在過程I中會轉化成硫酸亞鐵和硫酸。該過程發生反應的化學方程式為_____;
②某種反硫化細菌在過程II中需要有乳酸參與反應消耗硫酸生成H2S并伴有熱量放出,那么乳酸除在反應中作還原劑外,還存在另一作用,請解釋原因:_____;
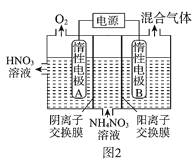
(3)電解法除去工業廢水中的硝酸銨的裝置示意圖如圖2所示,陰極電極反應式為____;
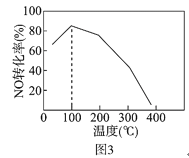
(4)向恒容密閉容器中充入1molNO和2molO3,發生如下反應:NO(g)+O3(g) NO2(g)+O2(g) △H<0不同溫度下反應相同時間后,體系中NO轉化率隨溫度變化曲線如圖3。溫度低于100℃時,NO轉化率隨溫度升高而增大的主要原因是_____;當溫度高于100℃時,NO轉化率隨溫度升高而降低,原因是_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】聚碳酸酯( )的透光率良好。它可制作車、船、飛機的擋風玻璃,以及眼鏡片、光盤、唱片等。它可用綠色化學原料X(
)的透光率良好。它可制作車、船、飛機的擋風玻璃,以及眼鏡片、光盤、唱片等。它可用綠色化學原料X(![]() )與另一原料Y反應制得,同時生成甲醇。下列說法不正確的是
)與另一原料Y反應制得,同時生成甲醇。下列說法不正確的是
A. Y的分子結構中有2個酚羥基 B. Y的分子式為C15H18O2
C. X的核磁共振氫譜有1個吸收峰 D. X、Y生成聚碳酸酯發生的是縮聚反應
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法錯誤的是
A. 11.2 L 甲烷和乙烯的混合物中含氫原子數目等于2NA
B. 含NA個 CO32-的 Na2CO3溶液中,Na+數目大于2NA
C. 密閉容器中,2 molSO2和足量 O2充分反應,產物的分子數小于2NA
D. 4.0 g CO2氣體中含電子數目等于2NA
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上用菱錳礦(MnCO3)[含FeCO3、SiO2、 Cu2 (OH)2 CO3等雜質]為原料制取二氧化錳.其工藝流程示意圖如下圖所示:
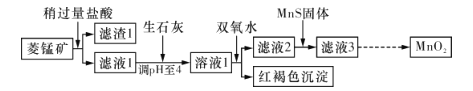
已知生成氫氧化物沉淀的pH如下表所示:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
開始沉淀時 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀時 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金屬離子的起始濃度均為0.1mol·L—1
請回答下列問題:
(1)含雜質的菱錳礦使用前需將其粉碎,主要目的是__________;鹽酸溶解MnCO3的化學方程式是____________________________。
(2)向溶液1中加入雙氧水時.發生反應的離子方程式是_________________。
(3)向濾液2中加入稍過量的難溶電解質MnS,以除去Cu2+,發生反應的離子方程式是_________________________。
(4)將MnCl2轉化為MnO2的一種方法是氧化法。其具體做法是用酸化的NaClO3溶液將MnCl2氧化,請完成該反應的離子方程式:5Mn2++2ClO3—+____===____+_____+_____。
(5)將MnCl2轉化為MnO2的另一種方法是電解法.
①生成MnO2的電極反應式是______________________。
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.則無Cl2產生.其原因是______。
查看答案和解析>>
科目: 來源: 題型:
【題目】根據下列圖示所得出的結論不正確的是( )
A.圖甲表示2SO2(g)+O2(g)2SO3(s)△H<0,t1時改變的條件是增大體系的壓強
B.圖乙NaCl溶液濃度過高鐵腐蝕速率降低,說明NaCl濃度越大溶液中O2的濃度越小
C.圖丙說明石墨轉化為金剛石的反應的△H>0
D.圖丁是一定條件下發生反應:4NH3+4NO+O24N2+6H2O,此過程△H<0
查看答案和解析>>
科目: 來源: 題型:
【題目】從粗銅精煉的陽極泥(主要含有Cu2Te)中提取粗碲的一種工藝流程如圖:(已知TeO2微溶于水,易溶于強酸和強堿) 下列有關說法正確的是

A. “氧化浸出”時為使碲元素沉淀充分,應加入過量的硫酸
B. “過濾”用到的玻璃儀器:分液漏斗、燒杯、玻璃棒
C. “還原”時發生的離子方程式為2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判斷粗碲洗凈的方法:取少量最后一次洗滌液,加入BaCl2溶液,沒有白色沉淀生成
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)化合物A(C4H10O)是一種有機溶劑。A可以發生以下變化:
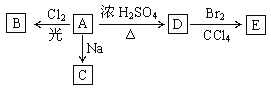
①A分子中的官能團名稱是_______。A的同分異構共有_________種(包括A本身)
②A只有一種一氯取代物B。寫出由A轉化為B的化學方程式:_________________。
③A的同分異構體F也可以有框圖內A的各種變化,且F的一氯取代物有三種。則F的結構簡式是____________。
(2)化合物“HQ”(C6H6O2)可用作顯影劑,“HQ”可以與三氯化鐵溶液發生顯色反應。“HQ”還能發生的反應是(填序號)_________
① 加成反應 ②氧化反應 ③加聚反應 ④水解反應
“HQ”的一硝基取代物只有一種。“HQ”的結構簡式是______________。
(3)A和“HQ”在一定條件下相互作用形成水與一種食品抗氧化劑“TBHQ”。“TBHQ”與氫氧化鈉溶液作用得到化學式為C10H12O2Na2的化合物。“TBHQ”的結構簡式是_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com