
科目: 來源: 題型:
【題目】為驗證鹵素單質氧化性的相對強弱,某小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢查)。
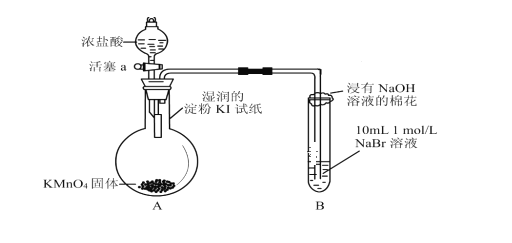
實驗時打開彈簧夾,打開活塞a,滴加濃鹽酸,使濃鹽酸與酸性KMnO4反應。
(1)驗證氯氣的氧化性強于碘的實驗現象是___________________。
(2)B中溶液發生反應的離子方程式是___________。
(3)反應完全后,可往B中加入CCl4來分離提純,該實驗過程名稱為________。
(4)實驗室制氯氣通常使用濃鹽酸與二氧化錳在加熱的條件下反應,試寫出該反應的化學方程式____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】鉛蓄電池是典型的可充電電池,電池總反應式為:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。回答下列問題:
2PbSO4+2H2O。回答下列問題:
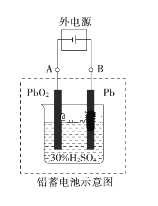
(1)放電時,負極為_______電極,試寫出該電極的電極反應式是___________。電解液中H2SO4的濃度將變____________。(填“升高”、 “降低” 或“不變”)
(2)電池放電時,當外電路通過0.1 mol電子時,理論上負極板的質量增加________g,電池中消耗的硫酸物質的量為_______mol。
查看答案和解析>>
科目: 來源: 題型:
【題目】(Ⅰ)下列敘述正確的有_______________
A.第四周期元素中,錳原子價電子層中未成對電子數最多
B.第二周期主族元素的原子半徑隨核電荷數增大依次減小
C.鹵素氫化物中,HCl的沸點最低的原因是其分子間的范德華力最小
(Ⅱ)M是第四周期元素,最外層只有1個電子,次外層的所有原子軌道均充滿電子。元素Y的負一價離子的最外層電子數與次外層的相同。回答下列問題:
(1)單質M的晶體類型為______,晶體中原子間通過_____作用形成面心立方密堆積,其中M原子的配位數為______。
(2)元素Y基態原子的核外電子排布式為________,其同周期元素中,第一電離能最大的是______(寫元素符號)。元素Y的含氧酸中,酸性最強的是________(寫化學式),該酸根離子的立體構型為________。
(3)M與Y形成的一種化合物的立方晶胞如圖所示。
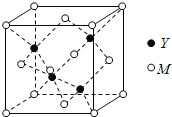
①該化合物的化學式為_______,已知晶胞參數a=0.542 nm,此晶體的密度為_______g·cm–3。(寫出計算式,不要求計算結果。阿伏加德羅常數為NA)
②該化合物難溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空氣則被氧化為深藍色,深藍色溶液中陽離子的化學式為_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】我國某物理研究所取得重大科技成果,研制出由18O所構成的單質氣體。18O是一種穩定的同位素,稱為重氧。下列有關說法不正確的是( )
A.1.8 g 18O構成的雙原子氣體分子的物質的量是0.05 mol
B.0.1 mol重氧水H218O所含的中子數約為6.02×1023
C.0.2 mol 18O2氣體的體積約為4.48 L
D.18O2的摩爾質量為36 g·mol-1
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)在標準狀況下,1.7g氨氣所占的體積為_______L,它與標準狀況下______L硫化氫含有相同數目的氫原子。
(2)某氣態氧化物的化學式為RO2,在標準狀況下,1.28g該氧化物的體積為448mL,則該氧化物的摩爾質量為_______,R的相對原子質量為_________。
(3)已知CO、CO2的混合氣體質量共16.0g,標準狀況下體積為8.96L,則可推知該混合氣體中含CO___g,所含CO2在標準狀況下的體積為_______L。
(4)同溫同壓下,SO2與Cl2的密度之比為______;若質量相同,兩種氣體的體積比為_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】欲用98%的濃硫酸(密度為1.84g·cm-3)配制成濃度為0.5mol·L-1的稀硫酸480mL。
(1)選用的主要儀器有:量筒、玻璃棒、膠頭滴管、燒杯、_______。
(2)請將下列各操作,按正確的序號填在橫線上。
A.用量筒量取濃H2SO4 B.反復顛倒搖勻
C.用膠頭滴管加蒸餾水至刻度線 D.洗凈所用儀器
E.稀釋濃H2SO4 F.將溶液轉入容量瓶
其操作正確的順序依次為_______。
(3)簡要回答下列問題:
①所需濃硫酸的體積為_______mL。
②如果實驗室有15mL、20mL、50mL的量筒應選用_____mL的量筒最好,量取時發現量筒不干凈用水洗凈后直接量取將使濃度____(“偏高”、“偏低”、“無影響”)。
③將濃硫酸沿燒杯內壁慢慢注入盛水的燒杯中,并用玻璃棒不斷攪拌的目的是_____,若攪拌過程中有液體濺出結果會使濃度偏______。
④在轉入容量瓶前燒杯中液體應______,否則會使濃度偏_______;并洗滌燒杯和玻璃棒2~3次,洗滌液也要轉入容量瓶,否則會使濃度_______。
⑤定容時必須使溶液凹液面與刻度線相切,若俯視會使濃度_____;仰視則使濃度______。
查看答案和解析>>
科目: 來源: 題型:
【題目】東晉《華陽國志·南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品。回答下列問題:
(1)鎳元素基態原子的電子排布式為______,3d能級上的未成對電子數為_______。
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液。
①[Ni(NH3)6]SO4中陰離子的立體構型是________。
②在[Ni(NH3)6]SO4中Ni2+與NH3之間形成的化學鍵稱為______,提供孤電子對的成鍵原子是______。
③氨的沸點_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“極性”或“非極性”),中心原子的軌道雜化類型為_______。
(3)銅晶體銅碳原子的堆積方式如圖所示。
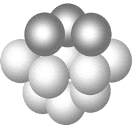
①基態銅在元素周期表中位置__________________。
②每個銅原子周圍距離最近的銅原子數目_________。
(4)某M原子的外圍電子排布式為3s23p5,銅與M形成化合物的晶胞如圖所示(黑點代表銅原子)。
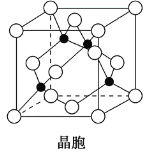
①該晶體的化學式為__________________。
②已知銅和M的電負性分別為1.9和3.0,則銅與M形成的化合物屬于________(填“離子”或“共價”)化合物。
③已知該晶體的密度為ρ g·cm-3,阿伏加德羅常數為NA,則該晶體中銅原子和M原子之間的最短距離為________pm(只寫計算式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關氣體體積的敘述正確的是( )
A.一定溫度和壓強下,各種氣態物質體積的大小,由構成氣體的分子大小決定
B.一定溫度和壓強下,各種氣態物質體積的大小,由構成氣體的分子數決定
C.不同的氣體,若體積不同,則它們所含的分子數也不同
D.氣體摩爾體積指1mol任何氣體所占的體積約為22.4L
查看答案和解析>>
科目: 來源: 題型:
【題目】鉀和碘的相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1)準晶是一種無平移周期序,但有嚴格準周期位置序的獨特晶體,可通過________方法區分晶體、準晶體和非晶體。
(2)基態K原子中,核外電子排布圖是_________,占據最高能層電子的電子云輪廓圖形狀為___________。K和Cr屬于同一周期,且核外最外層電子構型相同,但金屬K的熔點、沸點等都比金屬Cr低,原因是______________________________________。
(3)測定發現I3AsF6中存在I3+離子。I3+離子的幾何構型為_____________,中心原子的雜化類型為________________。
(4)KIO3晶體是一種性能良好的非線性光學材料,具有鈣鈦礦型的立體結構,邊長為a=0.446nm,晶胞中K、I、O分別處于頂角、體心、面心位置,如圖所示。K與O間的最短距離為______nm,與K緊鄰的O個數為__________。

(5)在KIO3晶胞結構的另一種表示中,I處于各頂角位置,則K處于______位置,O處于______位置。
查看答案和解析>>
科目: 來源: 題型:
【題目】X、Y、Z、W是質子數依次增大的短周期主族元素,它們形成的某種化合物Q的結構式如圖所示。X與W形成的化合物M常溫下是液體。下列說法正確的是
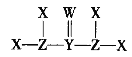
A.X與Z可形成質子數、電子數均相同的ZX3、![]()
B.M熱穩定性強且具有弱氧化性
C.Q分子中各原子最外電子層均達到穩定結構
D.X、Y、Z、W四種元素間只能形成共價化合物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com