
科目: 來源: 題型:
【題目】在高壓下氮氣會發生聚合得到高聚氮,這種高聚氮的N—N鍵的鍵能為160kJ·mol-1(N2的鍵能為942kJ·mol-1),晶體片段結構如右圖所示。又發現利用N2可制取出N5、N3。含N5+離子的化合物及N60、N5極不穩定。則下列說法錯誤的是( )

A. 按鍵型分類,該晶體中含有非極性共價鍵
B. 含N5+離子的化合物中既有離子鍵又有共價鍵
C. 高聚氮與N2、N3、N5、N5+、N60互為同素異形體
D. 這種固體的可能潛在應用是烈性炸藥或高能材料
查看答案和解析>>
科目: 來源: 題型:
【題目】為了監測某煙道氣中的NOx的含量,選用如下采樣和檢測方法。

I.采樣步驟
①檢驗系統氣密性;②加熱器將煙道氣加熱至140℃;③打開抽氣泵置換系統內空氣;④采集無塵、干燥的氣樣;⑤關閉系統,停止采樣。
(1)A中裝有無堿玻璃棉,其作用是___。采樣步驟②加熱煙道氣的目的是___。
C中填充的干燥劑最好的選擇是___(選填編號)。
a.堿石灰 b.無水CuSO4 c.P2O5
(2)用實驗室常用儀器組裝一套裝置,其作用與D(裝有堿液)相同,在虛線框中畫出該裝置的示意圖,標明氣體的流向及試劑___。

Ⅱ.NOx含量的測定
將一定量的氣樣通入適量酸化的H2O2溶液中,使NOx完全被氧化為NO3-,然后加入過量的FeSO4標準溶液,充分反應后,再用K2Cr2O7標準溶液滴定剩余的Fe2+。
(3)NO被H2O2氧化為NO3-的離子方程式是___。滴定操作使用的玻璃儀器主要有___。
(4)滴定過程中發生下列反應:3Fe2++NO3+4H+=NO↑+3Fe3++2H2O、Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O。判斷下列情況對NOx含量測定結果的影響(填“偏高”、“偏低”或“無影響”):若缺少采樣步驟③,會使測試結果___;若FeSO4標準溶液部分變質,會使測定結果___。
查看答案和解析>>
科目: 來源: 題型:
【題目】氧化還原反應的應用比較廣泛。閱讀下面的材料,結合相關化學知識回答下列問題。黑火藥主要是硝酸鉀、硫磺、木炭三者粉末的混合物,在點燃條件下,其化學反應式主要為:2KNO3+S+3C=N2↑+3CO2↑+K2S
(1)在黑火藥燃燒的反應中,氧化劑為___;
(2)該反應被氧化的元素是___;
(3)該反應的氧化產物是___;
(4)KNO3中N元素的化合價是___;
(5)根據化學反應式分析,一個硫原子參與反應時轉移___個電子;
(6)把Cl2通入濃氨水中,發生如下反應:3Cl2+8NH3=6NH4Cl+N2。用雙線橋表示反應的電子轉移方向和數目:___。
(7)已知存在下列反應:①ClO3-+5Cl-+6H+ =3Cl2+3H2O ②2Fe2++Cl2=2Fe3++2 Cl-。則ClO3-、Fe3+、Cl2三種微粒氧化能力由強到弱的順序是___。
查看答案和解析>>
科目: 來源: 題型:
【題目】向Ba(OH)2和NaOH的混合溶液中逐漸通入CO2氣體至過量,生成沉淀的物質的量(n)和通入CO2氣體的(V) 的關系如圖所示,試回答:

(1)0到a點之間的反應的離子方程式__________
(2)a到b點之間的反應的離子方程式__________
(3)b點之后的反應的離子方程式______________
(4)c 點CO2的體積__________mL(同溫同壓下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物質的量之比為__________
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上可由氫氣、氮氣合成氨氣,溶于水形成氨水。一定溫度下,向2L固定體積的密閉容器中加入N2(g)和H2(g),發生反應:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),NH3物質的量隨時間的變化如圖所示。
2NH3(g)+Q(Q>0),NH3物質的量隨時間的變化如圖所示。
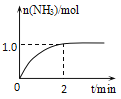
(1)0~2min內的平均反應速率v(H2)=___。
(2)該溫度下,反應的平衡常數表達式K=___。
其平衡常數K與溫度T的關系如下表:
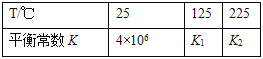
試判斷K1___K2(填寫“>”、“=”或“<”)。
(3)能說明該合成氨反應已達到平衡狀態的是___(選填編號)。
a.3v(N2)=v(H2)
b.容器內壓強保持不變
c.混合氣體的密度保持不變
d.25℃時,測得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
常溫下,某同學將鹽酸與氨水等體積混合,兩種溶液的濃度和混合后所得溶液的pH如表。
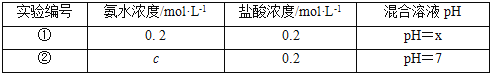
請回答:
(4)①中所得混合溶液,pH___7(填“>”、“<”或“=”);②中c__0.2(填“>”、“<”或“=”),所得混合溶液中各離子濃度大小關系為___。
(5)請你設計一個能證明一水合氨是弱電解質的簡要方案___。
查看答案和解析>>
科目: 來源: 題型:
【題目】用VSEPR模型預測下列分子或離子的立體結構,其中正確的是 ( )
A. H2O與BeCl2為角形(V形) B. CS2與SO2為直線形
C. SO3與CO![]() 為平面三角形 D. BF3與PCl3為三角錐形
為平面三角形 D. BF3與PCl3為三角錐形
查看答案和解析>>
科目: 來源: 題型:
【題目】原子序數小于36的X、Y、Z、W四種元素,X基態原子的最外層電子數是其內層電子數的2倍,Y基態原子的2p原子軌道上有3個未成對電子,Z是地殼中含量最多的元素,W的原子序數為24。
(1)W基態原子的核外電子排布式為___________,元素X、Y、Z的第一電離能由大到小的順序為___________(用元素符號表達);
(2)與XYZ-互為等電子體的化學式為___________;
(3)1molHYZ3分子中含有σ鍵的數目為___________;
(4)YH3極易溶于水的主要原因是___________。
查看答案和解析>>
科目: 來源: 題型:
【題目】按要求填空:
(1)質量數為37的氯原子符號為_______。
(2)S2-的結構示意圖為______。
(3)氮原子的電子式為______,N2的電子式為______,NH4+的電子式為_________
(4)磷原子的核外電子排布式為______,其價電子排布式為_____,其價電子排布圖為_____。
(5)含有半滿p軌道的最輕原子的核外電子排布式為_______,元素名稱為_______;
(6)最活潑的非金屬元素原子的核外電子排布式為_______,元素名稱為_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】硒是動物和人體所必需的微量元素之一,在周期表中信息如圖所示。完成下列填空:

(1)Se元素在周期表中的位置為___。表中78.96的意義為__。Se原子最外層電子排布的軌道表示式為___。
(2)從原子結構角度解釋硫的非金屬性大于硒___。
(3)硒化氫(H2Se)是一種有惡臭味的有毒氣體,是一種___(選填“極性、或非極性”)分子,其空間結構為___型。
(4)工業上常用濃H2SO4焙燒CuSe的方法提取硒,反應產生SO2、SeO2的混合氣體,寫出反應的化學方程式___。理論上該反應每轉移1mol電子,可得到SeO2的質量為___g,得到SO2在標準狀況下的體積為___ L。
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上利用電解飽和食鹽水生產氯氣(Cl2)、燒堿和氫氣的化學方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(1)用雙線橋表示出電子轉移的方向和數目__,題干中反應改寫成離子方程式是___。
(2)電解食鹽水的過程中,氧化產物是___。
(3)電解食鹽水要求對粗食鹽水進行精制,以除去租食鹽水中含有的泥沙和SO42-、Ca2+,Mg2+等雜質離子。精制時依次加入氯化鋇溶液、純堿、燒堿,充分反應后過濾,在濾液中加入鹽酸中和至中性。鹽酸與濾液反應的離子方程式:___,___。
(4)請配平以下化學方程式:__Al+__NaNO3+__NaOH=__NaAlO2+__N2↑+__H2O。若反應過程中轉移5mol電子,則生成標準狀況下N2的體積為___L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com