
科目: 來源: 題型:
【題目】下表中對應關系正確的是
A | CH3CH3+Cl2 | 均為取代反應 |
B | 由油脂得到甘油 | 均發生了水解反應 |
C | Cl2+2Br=2Cl+Br2 | 均為單質被還原的置換反應 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均為水作還原劑的氧化還原反應 |
查看答案和解析>>
科目: 來源: 題型:
【題目】黃銅礦是工業煉銅的原料,含有的主要元素是硫、鐵、銅。請回答下列問題。
(1)Fe2+的電子排布式是____________________________。
(2)液態SO2可發生自偶電離![]() ,SO2屬于_____________(選填“極性分子”或“非極性分子”),
,SO2屬于_____________(選填“極性分子”或“非極性分子”),![]() 的空間構型是___________________。
的空間構型是___________________。
(3)范德華力可分為色散力、誘導力和取向力三類,其中取向力只存在于極性分子和極性分子之間,則H2S的水溶液中存在的取向力有_______種。
(4)乙硫醇(C2H5SH)是一種重要的合成中間體,分子中硫原子的雜化形式是____________。乙硫醇的沸點比乙醇的沸點低,原因是___________。
(5)黃銅礦主要成分X的晶胞結構及晶胞參數如圖所示,X的化學式是______________,其密度為_____________g/cm3(阿伏加德羅常數的值用NA表示)。
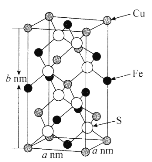
查看答案和解析>>
科目: 來源: 題型:
【題目】氫氧化鋰(LiOH)是重要的初加工鋰產品之一,可用于繼續生產氟化鋰、錳酸鋰等,在實驗室模擬用天然鋰輝石(主要成分是LiAlSi2O6)生產LiOH的一種工藝流程如圖所示:
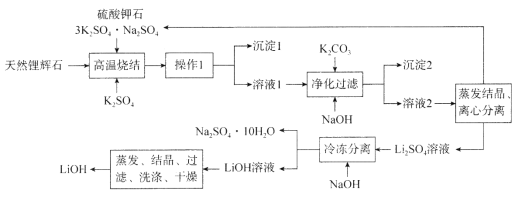
已知:溶液1中含有Li+、K+、Al3+、Na+、Fe3+、![]() 等離子。請回答下列相關問題。
等離子。請回答下列相關問題。
(1)高溫燒結的目的是________________________________________________。
(2)操作1是_____________________________。
(3)判斷LiOH已洗滌干凈的操作是______________________________________________。
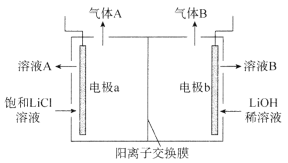
(4)工業生產中通過電解LiC1溶液的方法也可制得LiOH,其原理如圖所示,電極a應連接電源的_________(選填“正極”或“負極”),電極b發生的反應是__________,陽離子交換膜的作用是_________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列解釋有關事實的方程式不正確的是
A.鋁熱法煉鐵:Fe2O3+ 2Al![]() Al2O3+ 2Fe
Al2O3+ 2Fe
B.工業上用NH3制備NO:4NH3+ 5O2![]() 4NO十6H2O
4NO十6H2O
C.向受酸雨影響的湖泊中噴灑CaCO3粉末:CO![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
D.淀粉釀酒:(C6H10O5)n+nH2O![]() n C6H12O6,C6H12O6
n C6H12O6,C6H12O6![]() 2C2H5OH+2CO2
2C2H5OH+2CO2![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下向10mL0.1mol/L的NaCN溶液中滴加等濃度的鹽酸(忽略體積和溫度變化),δ(HCN)和![]() 隨溶液pH變化的圖像如圖所示,下列說法錯誤的是
隨溶液pH變化的圖像如圖所示,下列說法錯誤的是
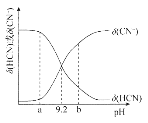
A.常溫下HCN的電離常數為l0-9.2
B.pH為9.2時,加入鹽酸的體積大于5mL
C.pH為a時溶液中c(Cl-)大于pH為b時溶液中c(Cl-)
D.滴加過程中可能出現:c(Na+)>c(CN-)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目: 來源: 題型:
【題目】下表是元素周期表的一部分,按要求回答下列問題:
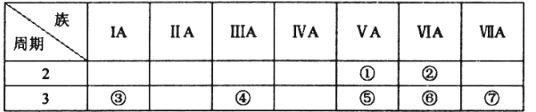
(l)①的簡單氫化物的電子式:_________________
(2)⑥的原子結構示意圖:________________
(3)⑤、⑥、⑦的最高價氧化物對應水化物的酸性由強到弱的順序為________________(用化學式表示),③的最高價氧化物對應水化物中含有的化學鍵的類型為________________
(4)能證明元素⑦比元素⑥的非金屬性強的實驗事實的是__________ (填字母)
A.常溫下元素⑦的單質為氣態,而元素⑥的單質為固態
B.元素⑦的氣態氫化物比元素⑥的氣態氫化物穩定
C.元素⑦的氧化物對應水化物比⑥的氧化物對應水化物酸性強
D.元素⑦的單質能與⑥的氫化物溶液反應生成⑥的單質
(5)④的單質在空氣中因表面氧化可以形成致密的氧化物保護膜,從而可以保護內部的單質不被氧化,該氧化物與NaOH溶液反應的離子方程式為____________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知酸性:![]() > H2CO3>
> H2CO3>![]() >HCO3-,綜合考慮反應物的轉化率和原料成本等因素,將
>HCO3-,綜合考慮反應物的轉化率和原料成本等因素,將 轉變為
轉變為 的最佳方法是
的最佳方法是
A. 與稀H2SO4共熱后,加入足量的NaOH溶液
B. 與稀H2SO4共熱后,加入足量的NaHCO3溶液
C. 與足量的NaOH溶液共熱后,再通入足量CO2
D. 與足量的NaOH溶液共熱后,再加入適量H2SO4
查看答案和解析>>
科目: 來源: 題型:
【題目】已知A的產量是衡量一個國家石油化工生產水平的重要標志,以A為主要原料合成一種具有果香味的物質E的生產流程如下:
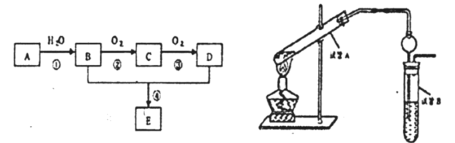
(1)有機物C的名稱是_______________
(2)寫出B→C的化學方程式________________
(3)請寫出B+D→E的化學方程式________________
(4)試管A中加少許碎瓷片的目的是_______________
(5)試管B中試劑的作用是____________________
(6)右邊試管接有一個球狀物代替了長導管,其作用為______________
(7)從制備乙酸乙酯所得的混合物中分離提純乙酸乙酯時,需要經過多步操作,下列圖示的操作中,肯定需要的化學操作是_____________(填字母)

(8)酯化反應是一一可逆反應, 為提高乙醇的利用率,可采取的措施是_______________。(任寫一種即可)
查看答案和解析>>
科目: 來源: 題型:
【題目】按要求回答下列問題:
(1) 一定溫度下,發生反應: 2 SO2(g)+ O2 (g)![]() 2SO3(g)(反應條件己略),現向2L密閉容器中充入4.0 mol SO2和2.0 mol O2發生反應,測得n (O2) 隨時間的變化如下表:
2SO3(g)(反應條件己略),現向2L密閉容器中充入4.0 mol SO2和2.0 mol O2發生反應,測得n (O2) 隨時間的變化如下表:

①0~2 min內,v(SO2)=_______________
②達到平衡時SO3的物質的量濃度為____________
③下列可證明上述反應達到平衡狀態的是____________(填序號)。
a. v(O2)=2v(SO3)
b. O2的物質的量濃度不再變化
c.每消耗1molO2,同時生成2molSO3
d.容器內壓強保持不變
(2)已知可逆反應: 2NO2(g) (紅棕色) ![]() N2O4(g) (無色),正反應為放熱反應。將裝有NO2和N2O4混合氣體的燒瓶放入熱水中,觀察到的現象______________ ,產生該現象的原因是________________
N2O4(g) (無色),正反應為放熱反應。將裝有NO2和N2O4混合氣體的燒瓶放入熱水中,觀察到的現象______________ ,產生該現象的原因是________________
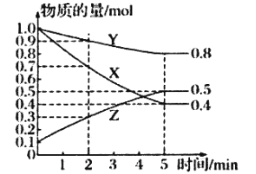
(3)某溫度下的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化曲線如圖,則該反應的化學方程式為_________________
查看答案和解析>>
科目: 來源: 題型:
【題目】物質X在一定條件下可轉化為物質Y或物質Z:
![]()
![]()
兩個反應的能量變化如圖所示,下列說法正確的是
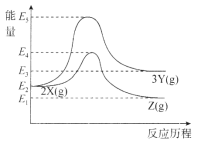
A.兩個反應均為放熱反應
B.X、Y、Z的關系是互為同素異形體或同分異構體
C.X轉化為Y的活化能高于X轉化為Z的活化能
D.其它條件一定,加壓有利于提高X轉化為Z的速率和平衡轉化率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com