
科目: 來源: 題型:
【題目】下列反應的離子方程式書寫不正確的是
A.硝酸銀溶液與鹽酸反應:Ag++HCl=AgCl↓+H+
B.鈉與水反應:2Na+2H2O=2Na++2OH-+H2↑
C.氯氣與氫氧化鈉溶液反應:Cl2+2OH-=Cl-+ClO-+H2O
D.銅與濃硝酸反應:Cu+4H++2![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】不同條件下,用O2氧化一定濃度的FeCl2溶液過程中所測的實驗數據如圖所示。下列分析或推測不合理的是
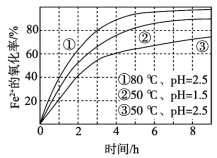
A. Fe2+的氧化率隨時間延長而逐漸增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,溫度越高,Fe2+氧化速率越快
D. 氧化過程的離子方程式為:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】芳香化合物F是有機化工的重要原料,也可制毒,受公安部管制。
已知:苯環上有烷烴基時,新引入的取代基連在烷烴基的鄰對位上;苯環上有羧基時,新引入的取代基連在羧基的間位上。
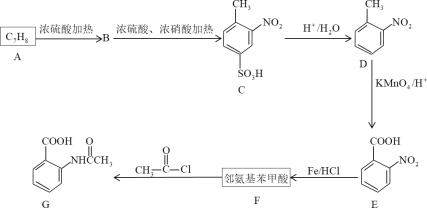
(1)D物質的名稱為___,G中官能團的名稱為___、___。
(2)A、F的結構簡式分別為___、___,E生成F的反應類型是___。
(3)寫出A→B產生較多的副產物的結構簡式___,該流程未采用甲苯直接硝化的方法制取D,而是經歷幾步反應才制得D的目的是___。
(4)F在一定條件下能發生聚合反應,請寫出其化學反應方程式___。
(5)F的同分異構體中,氨基直接連在苯環上、且能發生銀鏡反應的芳香族化合物共有___種(不含立體結構)。
(6)請以甲苯為原料,寫出合成間氨基苯甲酸的流程圖___(無機試劑任選)。合成流程圖表示方法示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 來源: 題型:
【題目】加強廢舊金屬的回收和再利用,是合理開發和利用金屬資源的主要途徑之一。如圖是從鍍銅廢電路板中回收金屬銅的一種工藝流程(各過程需控制適宜條件)。

(1)上述流程中,為加快化學反應速率而采取的措施是_____。
(2)過程Ⅰ中,過氧化氫在酸性條件下將Cu溶解,該反應的離子方程式是_____。
(3)過程Ⅱ中加入過量鐵粉的目的是_____,該過程中用到的分離操作是_____。
(4)過程Ⅲ中,發生反應的離子方程式為_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】某學習小組為測定放置已久的小蘇打樣品中純堿的質量分數,設計如下實驗方案:
(1)方案一:稱取一定質量的樣品,置于坩堝中加熱至恒重后,冷卻,稱取剩余固體質量,計算。
①完成本實驗需要不斷用玻璃棒攪拌,其目的是_______________________________。
②若實驗前所稱樣品的質量為m g,加熱至恒重時固體質量為a g,則樣品中純堿的質量分數為________。
(2)方案二:按如圖所示裝置進行實驗,并回答下列問題:
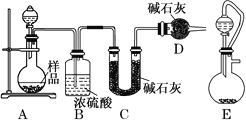
①實驗前先檢查裝置的氣密性,并稱取一定質量的樣品放入A中,將稀硫酸裝入分液漏斗中。D裝置的作用是________________。
②實驗中除稱量樣品質量外,還需分別稱量_______裝置反應前、后質量(填裝置字母代號)。
③根據此實驗得到的數據,測定結果有誤差。因為實驗裝置還存在一個明顯的缺陷,該缺陷是_________。
④有同學認為,用E裝置替代A裝置能提高實驗準確度。你認為是否正確?_________(填“是”或“否”)。
(3)方案三:稱取一定量的樣品置于錐形瓶中,加適量水,用鹽酸進行滴定,從開始至有氣體產生到氣體不再產生,所滴加的鹽酸體積如圖所示,則小蘇打樣品中純堿的質量分數為_________(保留兩位有效數字)。

查看答案和解析>>
科目: 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A. 100g 46%的乙醇溶液中,含H-O鍵的數目為NA
B. 1molNaHSO4在熔融狀態下電離出的陽離子數為2NA
C. 氫氧燃料電池負極消耗1.12L氣體時,電路中轉移的電子數為0.1NA
D. 常溫常壓下,92 g的NO2和N2O4混合氣體含有的原子數為6NA
查看答案和解析>>
科目: 來源: 題型:
【題目】前四周期的A、B、C、D、E五種元素,原子序數逐漸增大。A元素核外有三個電子層,最外層電子數是核外電子總數的1/6;B元素核外只有一個未成對電子,能與水劇烈反應;C元素正三價離子的3d軌道為半充滿狀態;D元素基態原子的M層全充滿,N層沒有成對電子,只有一個未成對電子;E元素的價電子構型為nsanpa+1,其某種氧化物有劇毒。
(1)A元素的第一電離能___Al元素的第一電離能(填“<”“>”或“=”),請解釋原因___。
(2)寫出B2O2與H2O反應過程中斷裂的化學鍵的種類___。
(3)C元素位于元素周期表的___區,它的價電子排布式是___,C(CO)x的中心原子價電子數與配位數提供的電子數之和為18,則x=___。
(4)D2O的熔點比D2S的熔點高,其原因是___。
(5)ECl3分子的立體構型為___,其中E的雜化類型為___,E元素可能的性質為___(從下列選項中選擇)。
A.其單質可作為半導體材料
B.其電負性大于磷
C.最高價氧化物對應的水化物是強酸
(6)以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱作原子分數坐標。BSiAl3O7屬于正交晶系(長方體形),晶胞參數為anm、bnm、cnm。如圖為沿y軸投影的晶胞中所有B原子的分布圖和原子分數坐標。據此推斷該晶胞中B原子數目為___;BSiAl3O7的摩爾質量為Mgmol-1,設NA為阿伏伽德羅常數的值,則晶體的密度=___(gcm3)。
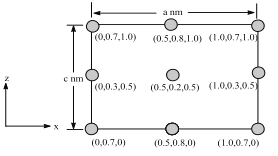
查看答案和解析>>
科目: 來源: 題型:
【題目】聚氯乙烯是制作裝修材料的最常用原料,失火時聚氯乙烯在不同的溫度下,發生一系列復雜的化學變化,產生大量有害氣體,其過程大體如下:

下列說法不正確的是
A. 聚氯乙烯的單體可由乙烯與HCl加成而得
B. 上述反應中①屬于消去反應,④屬于(脫氫)氧化反應
C. 火災中由聚氯乙烯產生的有害氣體中含HCl、CO、C6H6等
D. 在火災現場,可以用濕毛巾捂住口鼻,并彎下腰盡快遠離現場
查看答案和解析>>
科目: 來源: 題型:
【題目】海洋是一座巨大的化學資源寶庫,從中可以提取多種化學物質。從淡化海水中提取溴是海水綜合利用的重要途徑,其流程如圖:

完成下列填空
(1)寫出一種工業上海水淡化的方法_____。
(2)過程Ⅱ中物質X可以選SO2吸收溴,寫出該反應的化學方程式_____。
(3)過程I、Ⅱ要達到的目的是_____。
(4)寫出過程Ⅲ反應的離子方程式_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】碳元素形成的有機化合物在動植物體內及人類生存環境中有著相當廣泛的存在,起著非常重要的作用。請結合下列有關含碳化合物的研究,完成下列填空。
(1)為了高效利用能源并且減少CO2的排放,可用下列方法把CO2轉化成甲醇燃料:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=akJmol1
②2H2(g)+O2(g)=2H2O(g) △H=bkJmol1
③CH3OH(g)=CH3OH(l) △H=ckJmol1
④H2O(g)=H2O(l) △H=dkJmol1
則表示CH3OH(l)燃燒熱的熱化學方程式為___。
(2)用甲醇燃料電池電解處理酸性含鉻廢水(主要含有Cr2O72),用如圖裝置模擬該過程:
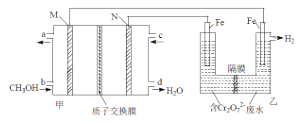
①請完成電解池中Cr2O72轉化為Cr3+的離子方程式___。
②當甲池中消耗甲醇1.6g時,乙池中兩電極的質量差為___g。
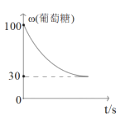
(3)葡萄糖和果糖為同分異構體,在一定條件下,C6H12O6(葡萄糖)![]() C6H12O6(果糖) △H﹤0。該反應的速率方程式可表示為v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定溫度下為常數,分別稱作正、逆反應速率常數。T1溫度下,k(正)=0.06s1,k(逆)=0.002s1。
C6H12O6(果糖) △H﹤0。該反應的速率方程式可表示為v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定溫度下為常數,分別稱作正、逆反應速率常數。T1溫度下,k(正)=0.06s1,k(逆)=0.002s1。
①T1溫度下,該反應的平衡常數K1=___。
②該反應的活化能Ea(正)___Ea(逆)(填“大于”、“小于”或“等于”)。
③該T2溫度下,從開始反應到平衡的過程中,葡糖糖的質量分數變化如圖所示。可以確定溫度T2___T1(填“大于”、“小于”或“等于”)。
(4)H2A為二元弱酸。室溫下配制一系列c(H2A)+c(HA)+c(A2)=0.100molL1的H2A與NaOH的混合溶液。測得H2A、HA、A2的物質的量分數c(x)%(c(x)%=![]() ×100%)隨pH變化如圖所示。
×100%)隨pH變化如圖所示。
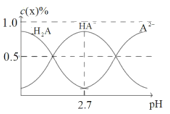
①當c(Na+)=0.100molL1時,溶液中離子濃度的大小順序為___。
②室溫下,若將0.100molL1的H2A與amolL1的NaOH溶液等體積混合,使溶液的pH=7。則H2A的Ka2=___molL1(用a表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com