
科目: 來源: 題型:
【題目】可由N物質通過以下路線合成天然橡膠和香料柑青酸甲酯衍生物F。

已知:

(1)用系統命名法對N命名________.
(2)①試劑a的名稱是________。②C→D中反應i的反應類型是________。
(3)E的結構簡式是_____________。
(4)關于試劑b的下列說法不正確是________(填字母序號)。
a. 存在順反異構體 b. 難溶于水c. 能發生取代、加成和氧化反應 d. 不能與NaOH溶液發生反應
(5)寫出A生成B的反應方程式_________。
(6)分子中含有![]() 結構的D的所有同分異構共有________種(含順反異構體),寫出其中任意一種含反式結構的結構簡式________。
結構的D的所有同分異構共有________種(含順反異構體),寫出其中任意一種含反式結構的結構簡式________。
查看答案和解析>>
科目: 來源: 題型:
【題目】一銅空氣燃料電池容量高、成本低,具有廣闊的發展前景。該電池通過一種復雜的銅腐蝕“現象”產生電能,其中放電過程為2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列說法不正確的是
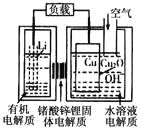
A. 放電時,Li+透過固體電解質向Cu極移動
B. 放電時,正極的電極反應式為O2+2H2O+4e-==4OH-
C. 通空氣時,銅被腐蝕,表面產生Cu2O
D. 整個反應過程中,氧化劑為O2
查看答案和解析>>
科目: 來源: 題型:
【題目】有機化合物K在化工和醫藥方面有重要的應用,其合成路線如下:

已知信息:
①C能發生銀鏡反應,E的相對分子質量比D大4,G的苯環上的一溴代物有兩種
②![]()
![]()
![]()
③2RCH2CHO![]()
![]()
請回答下列問題:
(1)F的名稱是__________,H含有的官能團是__________。
(2)A→B的反應類型是__________,F→G的反應類型是__________。
(3)C與銀氨溶液反應的化學方程式是__________。
(4)K的結構簡式是__________。
(5)符合下列要求的C8H10O的同分異構體有__________種.
①芳香族化合物②與Na反應并產生H2③遇FeCl3溶液呈紫色,
其中核磁共振氫譜為4組峰,且面積比為6:2:1:1的是__________(寫出其中一種結構簡式)
(6)參照已知信息和成路線,設計一條由CH2=CH2為原料合成CH3CH2CH2CH2OH的路線(注明反應條件):__________。
查看答案和解析>>
科目: 來源: 題型:
【題目】乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業。實驗室利用右圖的裝置制備乙酸乙酯。
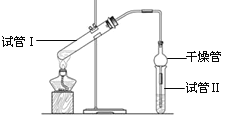
(1)與教材采用的實驗裝置不同,此裝置中采用了球形干燥管,其作用是: 。
(2)為了證明濃硫酸在該反應中起到了催化劑和吸水劑的作用,某同學利用上圖所示裝置進行了以下4個實驗。實驗開始先用酒精燈微熱3min,再加熱使之微微沸騰3min。實驗結束后充分振蕩小試管Ⅱ再測有機層的厚度,實驗記錄如下:
實驗編號 | 試管Ⅰ中試劑 | 試管Ⅱ中試劑 | 有機層的 厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 濃硫酸 | 飽和Na2CO3 溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、鹽酸 | 0.6 |
① 實驗D的目的是與實驗C相對照,證明H+對酯化反應具有催化作用。實驗D中應加入鹽酸的體積和濃度分別是______mL和_____mol·L-1 。
② 分析實驗 (填實驗編號)的數據,可以推測出濃H2SO4的吸水性提高了乙酸乙酯的產率。
(3)若現有乙酸90g,乙醇138g發生酯化反應得到80g乙酸乙酯,試計算該反應的產率為______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】氮及其化合物與人類生產、生活息息相關.回答下列問題:
(1)基態N原子中電子在2p軌道上的排布遵循的原則是__________,前4周期元素中,基態原子核外電子排布成單電子數最多的元素的價層電子排布式為__________。
(2)C、N、O三種元素第一電離能從大到小的順序是__________。
(3)N2F2分子中N原子的雜化方式是__________,l mol N2F2含有__________molσ鍵.
(4)NF3的鍵角__________NH3的鍵角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸銨)是合成氮化硼納米管的原料之一.l mol NH4BF4__________mol配位鍵.
(6)安全氣囊的設計原理為6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等電子體的原理是:原子總數相同,價電子總數相同的分子或離子具有相似的化學鍵特征,具有許多相近的性質.寫出兩種與N3-互為等電子體的分子或離子__________.
②Na2O的晶胞結構如圖所示,品胞邊長為566pm,晶胞中氧原子的配位數為__________,Na2O晶體的密度為__________gcm-3(只要求列算式,不必計算出結果)。

查看答案和解析>>
科目: 來源: 題型:
【題目】著名丹麥物理學家尼·玻爾(N·Bohr)將他鐘愛的金制諾貝爾獎章用王水溶解成“金溶液”,化學方程式可簡單表示為:Au+HNO3+3HCl===AuCl3+NO↑+2H2O,AuCl3+HCl===HAuCl4(四氯合金酸)。納粹分子對這種溶液“愚笨”得視而不見、毫無所知。戰爭結束后,物理學家又根據以下反應,煉出黃金并鑄出更加燦爛奪目的獎章:2HAuCl4![]() 2HCl↑+3Cl2↑+2Au。表現出偉大科學家對祖國的無比熱愛和非凡智慧。下列敘述中正確的是( )
2HCl↑+3Cl2↑+2Au。表現出偉大科學家對祖國的無比熱愛和非凡智慧。下列敘述中正確的是( )
A.王水能溶解黃金,但不能溶解白金
B.HAuCl4具有很強的氧化性
C.鹽酸有很強的還原性
D.濃鹽酸和濃硝酸按照體積比1:3能配成王水
查看答案和解析>>
科目: 來源: 題型:
【題目】原電池由A、B、C、D四種金屬按下表中裝置圖進行實驗。
裝置 |
|
|
|
現象 | 二價金屬A不斷溶解 | C的質量增加 | A上有氣體產生 |
根據實驗現象回答下列問題:
(1)裝置甲中負極的電極反應式是________________________________。
(2)裝置乙中正極的電極反應式是________________________________。
(3)裝置丙中溶液的pH________(填“變大”“變小”或“不變”)。
(4)四種金屬活動性由強到弱的順序是____________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】A、B、C、D、E、F分別代表原子序數依次增大的短周期元素。A和D屬同族元素;B和F位于第VIIA族;A和B可形成化合物AB4;C基態原子的s軌道和p軌道的電子總數相等;E的一種單質在空氣中能夠自燃。 請回答下列問題:
(1)D基態原子的電子排布式是_____________________。
(2)利用價層電子對互斥理論判斷EF3的立體構型是______。
(3)A所在周期元素最高價氧化物對應的水化物中,酸性最強的是______(填化學式);B和F的氫化物中沸點較高的是_____(填化學式);C、D、F的單質形成的晶體,熔點由高到低的排列順序是_______(填化學式)。
(4)CuSO4溶液能用作E4中毒的解毒劑,反應可生成E的最高價含氧酸和銅,該反應的化學方程式是_______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小。請回答下列問題:
(1)FeCl3凈水的原理是 。FeCl3 溶液腐蝕鋼鐵設備,除H+作用外,另一主要原因是(用離子方程式表示) 。
(2)為節約成本,工業上用NaClO3 氧化酸性FeCl2 廢液得到FeCl3。
①若酸性FeCl2廢液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,則該溶液的PH約為 。
②完成NaClO3 氧化FeCl2 的離子方程式:![]()
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反應的平衡常數K1、K2、K3由大到小的順序是 。
通過控制條件,以上水解產物聚合,生成聚合氧化鐵,離子方程式為:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移動可采用的方法是(填序號) 。
a.降溫 b.加水稀釋
c.加入NH4Cl d.加入NaHCO3
室溫下,使氯化鐵溶液轉化為高濃度聚合氯化鐵的關鍵條件是 。
(4)天津某污水處理廠用氯化鐵凈化污水的結果如下圖所示。由圖中數據得出每升污水中投放聚合氯化鐵[以Fe(mg·L-1)表示]的最佳范圍約為 mg·L-1。
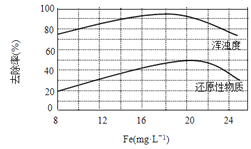
查看答案和解析>>
科目: 來源: 題型:
【題目】下圖中電極a、b分別為Ag電極和Pt電極,電極c、d都是石墨電極。通電一段時間后,在c、d兩極上共收集到336 mL(標準狀況)氣體。回答:

(1)直流電源中,M為____________極。
(2)Pt電極上生成的物質是____________,其質量為____________g。
(3)電源輸出的電子,其物質的量與電極b、c、d分別生成的物質的物質的量之比為:2∶_______∶________∶_________。
(4)AgNO3溶液的濃度(填“增大”“減小”或“不變”。下同)____________,H2SO4溶液的濃度____________。
(5)若H2SO4溶液的質量分數由5.00%變為5.02%,則原有5.00%的H2SO4溶液為______g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com