
科目: 來源:2017屆內蒙古赤峰市寧城縣高三一模理科綜合化學試卷(解析版) 題型:簡答題
亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌。某化學興趣小組同學展開對漂白劑亞氯酸鈉(NaClO2)的研究。
已知:NaClO2飽和溶液在溫度低于38 ℃時析出的晶體是NaClO2·3H2O,高于38 ℃時析出的晶體是NaClO2,高于60 ℃時NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用如圖所示裝置進行實驗。

(1)儀器a的名稱為____,裝置①的作用是____,裝置③的作用是______。
(2)裝置②中產生ClO2,涉及反應的化學方程式為________________;裝置④中反應生成NaClO2的化學方程式為_______________。
(3)從裝置④反應后的溶液獲得晶體NaClO2的操作步驟為:①減壓,55 ℃蒸發結晶;②趁熱過濾;③______;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能導致產品中混有的雜質是________。
(4)設計實驗檢驗所得NaClO2晶體是否含有雜質Na2SO4,操作與現象是:取少量晶體溶于蒸餾水,_____________________。
(5)為了測定NaClO2粗品的純度,取上述粗產品10.0 g溶于水配成1 L溶液,取出10 mL溶液于錐形瓶中,再加入足量酸化的KI溶液,充分反應后(NaClO2被還原為Cl-,雜質不參加反應),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3標準液滴定,達到滴定終點時用去標準液20.00 mL,試計算NaClO2粗品的純度_____。(提示:2Na2S2O3+I2 Na2S4O6+2NaI)
Na2S4O6+2NaI)
查看答案和解析>>
科目: 來源:2017屆內蒙古赤峰市寧城縣高三一模理科綜合化學試卷(解析版) 題型:簡答題
氮是地球上含量豐富的一種元素,“固氮”在工農業生產中有著重要作用,是幾百年來科學家一直研究的課題。下表列舉了不同溫度下大氣固氮和工業固氮的部分K值。
反應 | 大氣固氮 N2(g)+O2(g) | 工業固氮 N2(g)+3H2(g) | |||
溫度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
(1)①分析數據可知:大氣固氮反應屬于___________(填“吸熱”或“放熱”)反應。
②在一定溫度下,將一定足的N2和O2通入到體積為1L的密閉容器中,當“大氣固氮”反應達到平衡后,改變下列條件,能使平衡向正反應方向移動且平衡常數不變的是_______。
a.增大壓強 b.增大反應物的濃度 c.使用催化劑 d.升高溫度
③ 從分子結構角度解釋“大氣固氮”和“工業固氮”反應的活化能都很高的原因:________。
(2)分析表格數據可知“大氣固氮”的反應正向進行的程度小,不適合大規模生產,故世界各國均采用合成氨的方法進行工業固氮。
①從平衡移動角度考慮,工業固氮應該選擇常溫條件,但實際工業生產卻選擇500℃左右的高溫,解釋其原因_______________________。
②將0.1molN2和0.1molH2通入一容積可變的容器中進行工業固氮反應,則下圖所示N2的平衡轉化率在不同壓強(P1,P2)下隨溫度變化的曲線正確的是____________(填“A” 或“B”);比較P1、P2的大小關系________;若300℃、壓強P2時達到平衡,容器容積恰為100L,則此狀態下反應的平衡常數K=______________ (計算結果保留2位有效數字)。

③合成氨反應達到平衡后,t1時刻氨氣濃度欲發生圖C變化可采取的措施是____________。

(3)近年近年,又有科學家提出在常溫、常壓、催化劑等條件下合成氨氣的新思路,反應原理為:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),則其反應熱△H=____________。
(已知:N2(g)+3H2(g)?2NH3(g) △H1=-92.4kJ•mol-1;2H2(g)+O2(g)?2H2O(l) △H2=-571.6kJ•mol-1 )
查看答案和解析>>
科目: 來源:2017屆內蒙古赤峰市寧城縣高三一模理科綜合化學試卷(解析版) 題型:簡答題
鐵碳合金在現代建筑中占有十分重要的地位。
(1)基態Fe3+的M能層上電子排布式為_______,鐵元素可形成多種配合物,如K3[Fe(CN)6]和Fe(CO)5,則這兩種配合物所涉及的元素中,第一電離能由大到小的順序為________,電負性最大的是_______。
(2)三聚氰胺(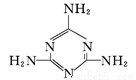 )中六元環結構與苯環類似,它與硝基苯的相對分子質量之差為3,三聚氰胺的熔點為354 ℃,硝基苯的熔點是5.7 ℃。
)中六元環結構與苯環類似,它與硝基苯的相對分子質量之差為3,三聚氰胺的熔點為354 ℃,硝基苯的熔點是5.7 ℃。
①三聚氰胺中,環上與環外的氮原子雜化軌道類型分別為_______。
②導致三聚氰胺與硝基苯熔點相差很大的根本原因是____________________。
(3)已知常溫下草酸(HOOC—COOH)的電離平衡常數Ka1=5.6×10-2、Ka2=1.5×10-4,試從結構上解釋Ka1、Ka2數值上的差異__________________。
(4)一定條件下,碳、氮兩種元素可形成一種化合物,該化合物可作耐磨材料,其熔點________(填“高于”、“低于”或“無法判斷”)金剛石的熔點。
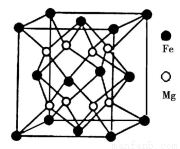
(5)鐵鎂合金是目前已發現的儲氫密度最高的儲氫材料之一,其晶胞結構如圖所示。則鐵鎂合金的化學式為________,若該晶胞的參數為dnm,則該合金的密度為____________(不必化簡,用NA表示阿伏加德羅常數)。
查看答案和解析>>
科目: 來源:2017屆內蒙古赤峰市寧城縣高三一模理科綜合化學試卷(解析版) 題型:推斷題
M通過下列關系可以得到阿司匹林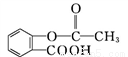 和能放出撲熱息痛(
和能放出撲熱息痛(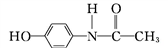 )的高分子藥物(
)的高分子藥物(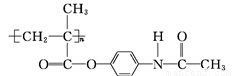 )。
)。
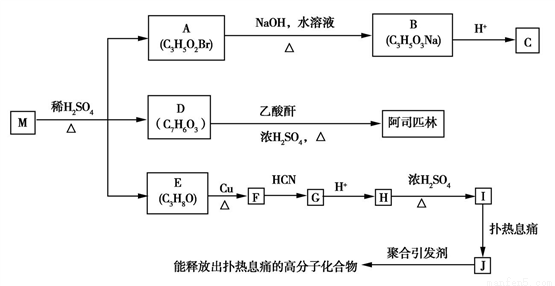
已知:①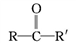
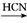

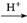
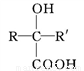 (R、R'表示氫原子或烴基);
(R、R'表示氫原子或烴基);
②C中含有一個甲基,且與H互為同系物。
請回答問題:
(1)I含有的官能團的名稱為________。
(2)F→G的反應類型為________,I→J的反應類型為_______。
(3)M的結構簡式為________。
(4)滿足下列條件的D的同分異構體有____種。
①能與FeCl3溶液發生顯色反應;②能發生銀鏡反應
(5)①E→F的化學方程式為_______________________。
②1 mol阿司匹林與足量NaOH溶液反應最多消耗NaOH的物質的量為________mol。阿司匹林與足量的NaOH溶液共熱的化學方程式為:_________________。
查看答案和解析>>
科目: 來源:2017屆安徽省安慶市高三第二次模擬考試理科綜合化學試卷(解析版) 題型:選擇題
化學與生產、生活、社會密切相關,下列有關說法中正確的是
A. 煤炭經氣化、液化和干餾等處理后,可轉化為清潔能源
B. “綠蟻新醅酒,紅泥小火爐”,“新醅酒”即新釀的酒,在釀酒的過程中,葡萄發生了水解反應
C. 地溝油和礦物油的主要化學成分相同
D. 聚氯乙烯可以用作食品包裝袋
查看答案和解析>>
科目: 來源:2017屆安徽省安慶市高三第二次模擬考試理科綜合化學試卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數值。下列有關敘述不正確的是
A. 5.8g熟石膏(2CaSO4·H2O)含有的結晶水分子數為0.02NA
B. 1mol CnH2n-2(n≥2)中所含的共用電子對數為(3n+1)NA
C. 60克的乙酸和葡萄糖混合物充分燃燒消耗2NA個O2
D. 在K37ClO3+6H35Cl(濃)=KCl+3Cl2↑+3H2O反應中,若有212克氯氣生成,則反應中電子轉移的數目為5NA
查看答案和解析>>
科目: 來源:2017屆安徽省安慶市高三第二次模擬考試理科綜合化學試卷(解析版) 題型:選擇題
下列關于有機化合物的說法不正確的是
A. 1,2-二甲苯也稱鄰二甲苯
B. 氨基乙酸與a-氨基丙酸的混合物一定條件下脫水能生成4種二肽
C. 苯與溴水不能發生加成反應,所以兩者混合后無明顯現象
D. C5H10O2屬于羧酸的同分異構體有4種
查看答案和解析>>
科目: 來源:2017屆安徽省安慶市高三第二次模擬考試理科綜合化學試卷(解析版) 題型:選擇題
僅用下表提供的玻璃儀器(非玻璃儀器任選),就能實現相應實驗目的的是
選項 | 實驗目的 | 玻璃儀器 |
A | 將溴水滴入KI溶液中,從溶液中分離生成的I2 | 膠頭滴管、試管、漏斗、玻璃棒、燒杯 |
B | 實驗室通過蒸餾的方法除去自來水中含有的Cl-等雜質制取蒸餾水 | 酒精燈、圓底燒瓶、冷凝管、尾接管、錐形瓶 |
C | 用植物油提取溴水中的Br2 | 鐵架臺、分液漏斗、玻璃棒、燒杯 |
D | 用濃氨水和氫氧化鈉固體制取氨氣 | 酒精燈、燒杯、導管、集氣瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 來源:2017屆安徽省安慶市高三第二次模擬考試理科綜合化學試卷(解析版) 題型:選擇題
新一代全固體鋰離子電池使用硫化物固體電解質,利用薄層成膜技術和加壓成型技術,提高了材料顆粒間的離子傳導性,從而實現了無需機械加壓的充放電。電池的工作原理為:LiMO2+nC Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),內部結構如圖所示。下列有關說法正確的是
Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),內部結構如圖所示。下列有關說法正確的是

A. 電池放電時,負極發生的反應為:nC+xLi++xe-=LixCn
B. 充電器的a 端接電源的負極,b端接電源的正極
C. 電池充電時Li+自左向右移動
D. 電池工作時,固體電解質因熔融而導電
查看答案和解析>>
科目: 來源:2017屆安徽省安慶市高三第二次模擬考試理科綜合化學試卷(解析版) 題型:選擇題
298K時,在20mLbmol·L-1氧氧化鈉溶液中滴入0.10mol·L-1的醋酸,溶液的pH與所加醋酸的體積關系如圖所示。下列有關敘述正確的是

A. a<20
B. C點溶液中:c(CH3COO-)+c(CH3C00H)=c(Na+)
C. A、B、C、D四點水的電離程度大小順序為:D>B>C>A
D. 醋酸的電離平衡常數Ka=2.0×10-7/(0.la-2)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com