
科目: 來源:2016-2017學年山東省高二下學期開學考試化學試卷(解析版) 題型:填空題
已知:I2+2S2O32-=S4O62-+2I-
相關物質的溶度積常數見下表:
物質 | Cu(OH)2藍色 | Fe(OH)3紅褐 | CuCl白色 | CuI白色 |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.02×10-6 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,為得到純凈的CuCl2·2H2O晶體,加入___________,調至pH=4,使溶液中的Fe3+轉化為Fe(OH)3沉淀,此時溶液中的c(Fe3+)=_________。過濾后,將所得濾液低溫蒸發、濃縮結晶,可得到CuCl2·2H2O晶體。
(2)在空氣中直接加熱CuCl2·2H2O晶體得不到純的無水CuCl2,原因是__________________(用化學方程式表示)。由CuCl2·2H2O晶體得到純的無水CuCl2的合理方法是_________________。
(3)某學習小組用“間接碘量法”測定含有CuCl2·2H2O晶體的試樣(不含能與I-發生反應的氧化性雜質)的純度,過程如下:取0.36 g試樣溶于水,加入過量KI固體,充分反應,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3標準溶液滴定,到達滴定終點時,消耗Na2S2O3標準溶液20.00 mL。
可選用_________作滴定指示劑,滴定終點的現象是________________。
CuCl2溶液與KI反應的離子方程式為_____________________。
查看答案和解析>>
科目: 來源:2016-2017學年廣東省高二上學期期末考試化學(理)試卷(解析版) 題型:簡答題
隨著科學技術的發展和環保要求的不斷提高,CO2的捕集利用技術成為研究的重點。
完成下列填空:
(1)目前國際空間站處理CO2的一個重要方法是將CO2還原,所涉及的反應方程式為:
CO2(g)+4H2(g)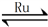 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的體積分數隨溫度的升高而增加。
若溫度從300℃升至400℃,重新達到平衡,判斷下列表格中各物理量的變化。(選填“增大”、“減小”或“不變”)
v正 | v逆 | 平衡常數K | 轉化率α |
______ | ______ | ______ | ______ |
(2)相同溫度時,上述反應在不同起始濃度下分別達到平衡,各物質的平衡濃度如下表:
c(CO2)/mol·L-1 | c(H2)/mol·L-1 | c(CH4)/mol·L-1 | c(H2O)/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d與m、n、x、y之間的關系式為_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
求0.1 mol/L Na2CO3溶液的pH___________0.1 mol/L Na2C2O4溶液的pH。(選填“大于”“小于”或“等于”)等濃度廣東草酸溶液和碳酸溶液中,氫離子濃度較大的是___________。
若將等濃度的草酸溶液和碳酸溶液等體積混合,溶液中各種離子濃度大小的順序正確的是_____。(選填編號)
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) d.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(4)人體血液中的碳酸和碳酸氫鹽存在平衡:H++ HCO3- H2CO3,當有少量酸性或堿性物質進入血液中時,血液的pH變化不大,用平衡移動原理解釋上述現象。________________________
H2CO3,當有少量酸性或堿性物質進入血液中時,血液的pH變化不大,用平衡移動原理解釋上述現象。________________________
查看答案和解析>>
科目: 來源:2016-2017學年廣東省高二上學期期末考試化學(理)試卷(解析版) 題型:簡答題
冬季是霧霾天氣高發的季節,其中汽車尾氣和燃煤尾氣是造成霧霾的原因之一。
(1)汽車尾氣凈化的主要原理為:2NO(g)+2CO(g)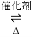 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①在一定條件下,在一個容積固定為2L的密閉容器中充入0.8molNO和1.20molCO,開始反應至3min時測得CO的轉化率為20%,則用N2表示的平均反應速率為V(N2)=__________。
②對于氣相反應,用某組分(B)的平衡壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作Kp),則該反應平衡常數的表達式Kp=______________。
③該反應在低溫下能自發進行,該反應的△H_______0,(選填“>”、“=”或“<”)
④在某一絕熱,恒容的密閉容器中充入一定量的NO、CO發生上述反應,測得正反應的速率隨時間變化的曲線如圖所示(已知t2—t1=t3—t2)。則下列說法不正確的是__________。(填編號)
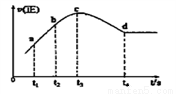
A.反應在c點未達到平衡狀態 B.反應速率a點小于b點
C.反應物濃度a點大于b點 D.NO的轉化率t1—t2=t2—t3
(2)使用甲醇汽油可能減少汽車尾氣對環境的污染,某化工廠用水煤氣為原料合成甲醇,恒溫條件下,在體積可變的密閉容器中發生反應:CO(g)+2H2(g)?CH3OH(g),到達平衡時,測得CO、H2、CH3OH分別為1mol、1mol、1mol,容器的體積為3L,現往容器中繼續通人3mol CO,此時v(正)____v(逆)(選填‘‘>”、“<’’或“=”),判斷的理由____________。
(3)二甲醚也是清潔能源,用合成氣在催化劑存在下制備二甲醚的反應原理為:
2CO(g)+4H2(g)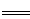 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定條件下,該反應中CO的平衡轉化率隨溫度、投料比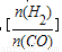 的變化曲線如圖:
的變化曲線如圖:
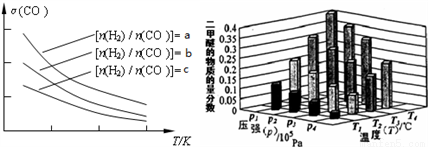
①a、b、c按從大到小的順序排序為___________。
②某溫度下,將2.0mol CO(g)和4.0mol H2(g)充入容積為2L的密閉容器中,反應到達平衡時,改變壓強和溫度,平衡體系中CH3OCH3(g)的物質的量分數變化情況如上圖所示,關于溫度和壓強的關系判斷正確的是___________;
A.P3>P2,T3>T2 B.P1>P3,T1>T3
C.P2>P4,T4>T2 D.P1>P4,T2>T3
③在恒容密閉容器里按體積比為1:2充入一氧化碳和氫氣,一定條件下反應達到平衡狀態.當改變反應的某一個條件后,下列變化能說明平衡一定向逆反應方向移動的是___________:
A.正反應速率先增大后減小
B.逆反應速率先增大后減小
C.化學平衡常數K值增大
D.反應物的體積百分含量增大
E.混合氣體的密度減小
F.氫氣的轉化率減小
查看答案和解析>>
科目: 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A. 手機外殼上貼的碳纖維外膜是一種新型的有機高分子材料
B. 綠色化學的核心是對環境產生的污染進行治理
C. 氯化銨、二氧化硫溶于水都能導電,所以它們都屬于電解質
D. 云、煙、霧等均能產生丁達爾現象
查看答案和解析>>
科目: 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:選擇題
下列有關化學用語的描述不正確的是( )
A. MgF2的電子式: 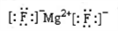
B. 中子數為15的硅原子: 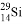
C. 乙烯的結構簡式:CH2CH2
D. NH3•H20 的電離方程式: NH3•H20  NH4+ + 0H-
NH4+ + 0H-
查看答案和解析>>
科目: 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:選擇題
下列有關說法正確的是( )
A. 實驗室中,可用金屬鈉檢驗乙醇中是否含有水
B. 甲烷是天然氣的主要成分,能發生取代反應,但不能發生氧化反應
C. 只用水無法鑒別苯、乙酸和四氣化碳
D. 植物油不能用于萃取漠水中的溴
查看答案和解析>>
科目: 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:選擇題
用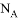 表示阿伏加德羅常數的值,下列說法正確的是( )
表示阿伏加德羅常數的值,下列說法正確的是( )
A. 在標準情況下,22.4L 含有的分子數為
含有的分子數為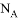
B. 1L 0.1 mol?L—1的MgCl2溶液中含Mg2+的數目為0.1NA
C. 17.6g丙烷中所含的共價鍵數目為4NA
D. 20 ml 2mol? L—1 H2O2完全分解,轉移的電子數為0.08NA
查看答案和解析>>
科目: 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:選擇題
四種短周期元素在周期表中的位置如下圖,其中只有M為金屬元素。下列說法不正確的是( )

A. 原子半徑Z < M
B. Y的最高價氧化物對應水化物的酸性比X 的弱
C. X 的最簡單氣態氫化物的熱穩定性比Z的小
D. Z位于元素周期表中第二周期第ⅥA族
查看答案和解析>>
科目: 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:選擇題
俗稱“一滴香”的有毒物質被人食用后會損傷肝臟,還能致癌.“一滴香”的分子結構如圖所示,下列說法正確的是( )
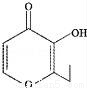
A. 該有機物的分子式為C7H7O3
B. 該有機物能發生取代、加成和氧化反應
C. 1mol該有機物最多能與2mol H2發生加成反應
D. 該有機物的一種含苯環的同分異構體能發生銀鏡反應
查看答案和解析>>
科目: 來源:2017屆福建省漳州市八校高三上學期期末聯考化學試卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A. 0.1mol•L﹣1CH3COONa溶液:H+、Al3+、Cl﹣、NO3﹣
B. 含有NaNO3的溶液:H+、Fe2+、SO42﹣、Cl﹣
C. 能使甲基橙變紅的溶液:K+、Na+、NO3﹣、Cl﹣
D. 由水電離產生的c(H+)=10﹣12 mol•L﹣1的溶液:NH4+、SO42﹣、HCO3﹣、Cl﹣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com