
科目: 來源:2017屆廣東省高三上學期期中化學試卷(解析版) 題型:推斷題
[化學──選修5:有機化學基礎]
Ⅰ﹒乙基香草醛(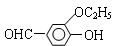 )是食品添加劑的增香原料,其香味比香草醛更加濃郁。
)是食品添加劑的增香原料,其香味比香草醛更加濃郁。
寫出乙基香草醛分子中兩種含氧官能團的名稱
Ⅱ﹒乙基香草醛的同分異構體A是一種有機酸,A可發生以下變化:
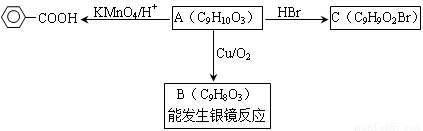
提示:①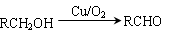
②與苯環直接相連的碳原子上有氫時,此碳原子才可被酸性KMnO4溶液氧化為羧基。
⑴A→C的反應屬于 (填反應類型)。寫出A的結構簡式:
⑵乙基香草醛的另一種同分異構體D(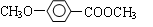 )是一種醫藥中間體,用茴香醛(
)是一種醫藥中間體,用茴香醛(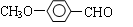 )經兩步反應合成D,請寫出第②步反應的化學方程式(其他原料自選,并注明必要的反應條件)。
)經兩步反應合成D,請寫出第②步反應的化學方程式(其他原料自選,并注明必要的反應條件)。
①
② ;
⑶乙基香草醛的同分異構體有很多種,滿足下列條件的同分異構體有 種。
①能與NaHCO3溶液反應 ②遇FeCl3溶液顯紫色,且能與濃溴水反應
③苯環上有兩個烴基 ④苯環上的官能團處于對位
其中有一種同分異構體的核磁共振氫譜中出現4組峰,吸收峰的面積之比為1∶1∶2∶6,該同分異構體的結構簡式為 ;
⑷現有溴、濃硫酸和其他無機試劑,寫出實現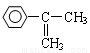 轉化為
轉化為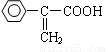 的合成線路:
的合成線路:
;
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
化學與生產、生活、科技等密切相關,下列說法正確的是
A.石油裂解的目的是提高汽油等輕質油的產量和質量
B.“神州七號”的防護層中含聚四氟乙烯,制備聚四氟乙烯的單體屬于不飽和烴
C.濃硫酸可用于干燥 SO2、C2H4、O2等氣體
SO2、C2H4、O2等氣體
D.用CO2合成可降解的聚碳酸酯塑料,可以實現“碳”的循環利用
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
分子式為C8H16O2的酯A,能在酸性條件下水解生成B和C,且B在一定條件下能氧化成D。D與C互為同分異構體。則有機物A可能的結構有
A.4種 B.3種 C.2種 D.1種
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
向100 mL 0.1 mol·L-1硫酸鋁銨[NH4Al(SO4 )2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。隨著 Ba(OH)2溶液體積V的變化,沉淀總物質的量n的變化如圖所示。則下列說法中正確的是( )
)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。隨著 Ba(OH)2溶液體積V的變化,沉淀總物質的量n的變化如圖所示。則下列說法中正確的是( )
A.a點發生反應的離子方程式是:
Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓
B.b點消耗Ba(OH)2溶液體積為200mL
C.從a→b 、b→c點過程中發生反應的離子方程式依次為:NH4++OH-=NH3·H2O;Al(OH)3+OH-=AlO2-+2H2O
D.沉淀的質量:a點>c點
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
設NA是阿伏加德羅常數的值,下列說法正確的是
A.7g分子式為CnH2n的鏈烴中含有的C—H鍵的數目為NA
B.標準狀況下,2.24 L CHCl3分子中共價鍵的數目為0.4NA
C.一定溫度下,l L l mol·L-1的CH3COONa溶液含NA個CH3COO—離子
D.1 mol SO2與足量O2在一定條件下反應生成SO3的數目為2NA
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
下列液體中,不會出現丁達爾效應的分散系是
①雞蛋白溶液 ②水 ③淀粉溶液 ④硫酸鈉溶液 ⑤沸水中滴入飽和FeCl3溶液 ⑥肥皂水
A.②④ B.①③ C.⑤⑥ D .④
.④
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
將pH=1的稀硫酸慢慢加入—定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此時溶液的體積為100 mL(混合時溶液體積的變化忽略不計),且混合溶液的pH=2,則原BaCl2溶液中Cl-的濃度約為
A.0.011 mol/L B.0.22 mol/L
C.0.022 mol/L D.0.11 mol/L
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
元素X的單質及X與Y形成的化合物能按如右圖所示的關系發生轉化: 則X為
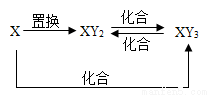
A.Fe B.Cu C.S D.C
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:填空題
CH3COOH為常見的弱酸,在工業生產和生活中有廣泛的應用。
I.(1)常溫下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物質的量濃度的NaOH溶液的體積分別為V1和V2,則V1_______V2(填“>”、“ =”或“<”)。
=”或“<”)。
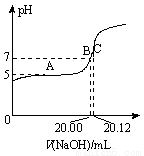
(2)常溫下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知濃度的CH3COOH溶液,滴定曲線如圖所示。其中A點所示溶液中c(CH3COO-)=2c(CH3COOH),C點所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。則常溫下CH3COOH的電離常數Ka=_________,CH3COOH溶液的實際濃度為____________。
Ⅱ.1100℃時,體積為2 L的恒容容器中發生如下反應:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判斷反應達到平衡狀態的是________。
A.容器中壓強不變
B.混合氣體密度不變
C.1 mol H-H鍵斷裂同時形成2 mol H-O
D.H2的體積分數不變
(2)若2 min時反應達平衡,此時氣體質量增加8 g,則用H2表示該反應的反應速率為___________。
(3)某溫度下該反應達平衡狀態,測得混合氣體的平均相對分子質量為14,則該溫度下的平衡常數K為_____________。
(4)若降低溫度,K值減小,則反應的ΔH______0(填“>”或“<”)。
(5)若反應達平衡后,加入少量的H2,再次平衡后,H2O的體積分數___________(填“增大”、“減小”或“不變”)。
查看答案和解析>>
科目: 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:填空題
I.氮及其化合物在工農業生產、生活中有著重要應用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一。
(1)已知:2NO(g) = N2(g)+O2(g) △H=﹣180.5kJ•mol-¹
C(s)+O2(g)=CO2(g) △H=﹣393.5 kJ•mol -¹
-¹
2C(s)+O 2(g)=2CO(g) △H=﹣221kJ•mol-¹
若某反應的平衡常數表達式為: ,請寫出此反應的熱化學方程式 。
,請寫出此反應的熱化學方程式 。
(2)N2O5在一定條件下可發生分【解析】
2N2O5(g)=4NO2(g)+O2(g)。某溫度下測得恒容密閉容 器中N2O5濃度隨時間的變化如下表:
器中N2O5濃度隨時間的變化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①2.00min~5.00 min內,NO2的平均反應速率為 ;已知氣體的物質的量與體系壓強成正比,若反應開始時體系壓強為P0,第4.00 min時體系壓強為P1,則P1∶ P0= ;
P0= ;
②一定溫度下,在恒容密閉容器中充入一定量N2O5進行該反應,能判斷反應已達到化學平衡狀態的是 。
a.容器中壓強不再變化 b.NO2和O2的體積比保持不變
c.2υ正(NO2)=υ逆(N2O5) d.氣體的密度保持不變
II.雙氧水是一種重要的綠色試劑,工業上可采取電解較稀濃度的硫酸來制取雙氧水(H2O2只為還原產物),其電解的化學方程式為:3H2O+3O2  O3+3H2O2。則陽極的電極反應式為 ,陰極的電極反應式為 。
O3+3H2O2。則陽極的電極反應式為 ,陰極的電極反應式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com