
科目: 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:選擇題
25 ℃時,用 2a mol?L-1 NaOH 溶液滴定 1.0 L 2a mol?L-1 氫氟酸溶液,得到混合液中 HF、F-的物質的量與溶液 pH 的變化如圖所示。下列說法正確的是( )

A. pH=3 時,溶液中: c(Na+)>c(F-)
B. c(F-)>c(HF)時,溶液一定呈堿性
C. pH=4 時,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)< 2a mol?L-1
D. pH=3.45 時,NaOH 溶液恰好與 HF 完全反應
查看答案和解析>>
科目: 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:選擇題
對于密閉容器中可逆反應 A2(g)+3B2(g) 2AB3(g),探究單一條件改變情況下,可能引起平衡狀態的改變,得到如下圖所示的曲線(圖中T表示溫度,n 表示物質的量)下列判斷正確的是( )
2AB3(g),探究單一條件改變情況下,可能引起平衡狀態的改變,得到如下圖所示的曲線(圖中T表示溫度,n 表示物質的量)下列判斷正確的是( )
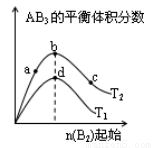
A.加入催化劑可以使狀態 d 變為狀態 b
B.若 T1>T2,則逆反應一定是放熱反應
C.達到平衡時 A2 的轉化率大小為: b>a>c
D.在T2 和n(A2)不變時達到平衡,AB3 的物質的量大小為: c>b>a
查看答案和解析>>
科目: 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:推斷題
A、B、C、D、E、W為六種前四周期元素,它們的原子序數依次增大. A 與 D 同主族,可形成 DA 型離子化合物,B與C同周期且相鄰,C與E同主族,E2-與 Ar 原子具有相同的電子層結構,W 的合金用量最大、用途最廣.請回答下列問題:
(1)D 在元素周期表中的位置___________.
(2)A 分別與 C、E 形成最簡單化合物中沸點較高的是________(填化學式),原因是____________.
(3)A、C、D三種元素形成的物質中含有的化學鍵類型______,灼熱的碳能與 B 的最高價氧化物對應水化物的濃溶液反應,化學反應方程式為_____________.
(4)向盛有A2C2 溶液的試管中加入幾滴酸化的WEC4 溶液,溶液變成棕黃色,發生反應的離子方程式為____________;一段時間后,溶液中有氣泡出現,并放熱,隨后有紅褐色沉淀生成,產生氣泡的原因是_______;生成沉淀的原因是____________(用平衡移動原理解釋).
查看答案和解析>>
科目: 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:推斷題
已知: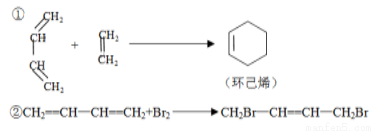
(1)寫出下列反應產物的結構簡式:
H2C=CHCH=CHCH3+H2C=CHCHO→ _______________。
(2)以某鏈烴A為起始原料合成化合物G 的路徑如下(圖中 Mr 表示相對分子質量)
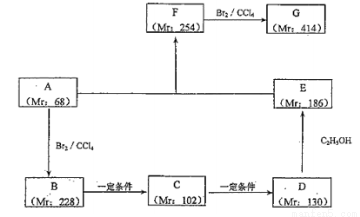
①寫出反應類型 B→C:_______,F→G:_______。
②寫出下列物質的結構簡式:A:________,F:_______。
③寫出下列反應的化學方程式:
B→C:________________;D→E:_______________。
④寫出 G 與氫氧化鈉溶液反應的方程式____________________。
查看答案和解析>>
科目: 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:填空題
重鉻酸鉀是一種常見的強氧化劑。實驗室以精選鉻鐵礦(主要成分可表示FeO·Cr2O3,還含有 SiO2、 Al2O3 等雜質)為原料制備重鉻酸鉀晶體(K2Cr2O7,式量294)的流程如下:
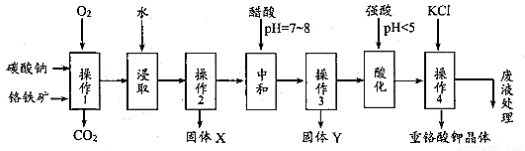
請回答下列問題:
操作1中發生的反應有:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
Na2CO3+Al2O3 2NaAlO2+CO2↑;Na2CO3+SiO2
2NaAlO2+CO2↑;Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
該步驟在常溫下的反應速度較慢,為使反應速率增大,可采取的兩條措施是____________。
(2)固體Y 中主要含有______________。(填寫化學式)
(3)酸化步驟使含鉻物質發生了轉化,請寫出離子反應方程式______________________。
(4)操作 4 中的化學反應在溶液中能發生的可能理由是_________________________;獲得 K2Cr2O7 晶體的操作依次是:加入KCl 固體,在水浴上加熱濃縮至______________,冷卻結晶,抽濾,洗滌,干燥。
(5)通過下列實驗可測定產品中重鉻酸鉀的質量分數:稱取重鉻酸鉀試樣 1.470g,用100mL 容量瓶配制成溶液。移取25.00mL 溶液于碘量瓶中,加入適里稀硫酸和足量碘化鉀(鉻的還原產物為 Cr3+),放于暗處 5min。然后加入一定量的水,加入淀粉指示劑,用0.1500mol/L 標準溶液滴定,共消耗標準液36.00mL。滴定時發生的反應的離子方程式為:I2+2S2O32-=2I-+S4O62-;則所測產品中重鉻酸鉀的純度為_____________。
(6)有關上述實驗過程中涉及的部分實驗操作的描述,正確的是_________.
A.粗產品若要進一步提純,可以采用重結晶的方法
B. 配制溶液時,用托盤天平稱取試樣后,一般經溶解、轉移(含洗滌)、定容等步驟,配制成100mL溶液
C.滴定時,當最后一滴標準溶液滴入時,溶液變為藍色,且半分鐘內不變色,可判斷滴定終點
D.滴定終點時俯視讀數,測定結果偏低
查看答案和解析>>
科目: 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:填空題
氮及其化合物在工農業生產生活中應用廣泛,請解決下列問題。
(1)化合物甲(由氮和另一種常見的主族元素組成)是一種新型無機材料。將 8.2g 甲溶于足量的氫氧化鈉溶液,可產生標準狀況下為 4.48L 的氣體,該氣體可作制冷劑。向反應后的溶滾中逐滴加入稀鹽酸,產生白色沉淀質量最大為 15.6g,繼續滴加沉淀消失。則甲溶于氫氧化鈉的化學方程式為_____________________。
(2)NH3催化還原氮氧化物是目前應用廣泛的煙氣氮氧化物脫除技術。例如:
4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H1
5N2(g)+6H2O(g) △H1
己知:①H2O(l)=H2O(g) △H2
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3
則 NH3(g)的標準燃燒熱△H=____________________。
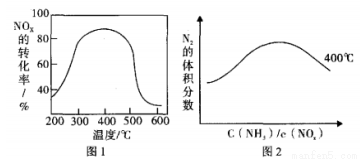
(3)以FeSO4作催化劑在不同溫度下,經過相同的時間測試氨還原氮氧化物效果如圖1,當反應在400~450℃,NOx 的轉化率隨溫度升高而降低。當體系溫度升至 500℃以上時. NOx 的轉化率迅速下降,其可能原因是______________________。圖2反映的是在400℃N2的體積分數與反應物中 c(NH3)/c(NOx)的關系,請在下面的圖2上畫出450℃的變化趨勢曲線。
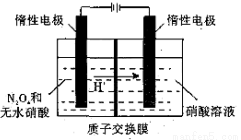
(4)N2O5 是綠色硝化試劑,溶于水可得硝酸。下圖是以 N2O4為原料電解制備N2O5的裝置示意圖。寫出陽極區生成 N2O5 的電極反應式是________________。
(5)常溫下,向 0.1mol/L 氨水中加入少許 N2O5,使溶液中 c(NH3·H2O):c(NH4+)=5:9,此時溶液的 pH=___________。( 25℃時. NH3·H2O 的電離平衡常數 Kb=1.8×10-5)
查看答案和解析>>
科目: 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
化學與生產、生活密切相關,下列敘述錯誤的是( )·
A.用熱的的純堿溶液清除灶具上的油污
B.用硫酸清洗鍋爐中的水垢
C.用明礬[KAl(SO4)2 ·12H2O]作凈水劑,除去水中懸浮的雜質
D.用Na2S作沉淀劑,除去廢水中的Cu2+和Hg2+
查看答案和解析>>
科目: 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
某學生的實驗報告所列出的下列數據中合理的是( )
A. 用10mL量筒量取8.16mL稀鹽酸
B. 用托盤天平稱量25.20g NaCl
C. 用廣泛pH試紙測得某溶液的pH為2.3
D. 用25mL堿式滴定管進行中和滴定時,用去某濃度的堿溶液21.70mL
查看答案和解析>>
科目: 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
下列解釋事實的方程式不正確的是( )
A.測0.1mol/L氨水的pH為11:NH3·H2O NH4++OH-
NH4++OH-
B.將Na塊放入水中,產生氣體:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做導電性實驗,燈泡發光:CuCl2 =Cu2++2Cl-
D.Al片溶于NaOH溶液中,產生氣體:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目: 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
在加入鋁粉能產生氫氣的溶液中,下列各組離子可能大量共存的是( )
A.Na+、 Ba2+、Cl-、NO3-
B. Fe2+、 K+、NO3-、Cl-
C.Na+、NH4+、AlO2-、 SO42-
D.NH4+、ClO-、SO42-、Na+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com