
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
下列熱化學方程式書寫正確的是( )
A.2SO2+O2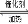 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol
B.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
C.在500℃、30MPa下,將0.5molN2和1.5molH2置于密閉容器中充分反應生成NH3(g),放出熱量19.3kJ,其熱化學方程式為:N2(g)+3H2(g)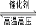 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
D.2.00gC2H2氣體完全燃燒生成液態(tài)水和二氧化碳氣體,放出99.6kJ的熱量,該反應的熱化學方程式為:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ/moL
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
下表中是各組反應的反應物和反應溫度,反應剛開始時放出H2速率最快的是( )
編號 | 金屬(粉末狀) | 酸的濃度及體積 | 反應溫度 |
A | Mg,0.1 mol | 6mol·L-1 硝酸10mL | 60℃ |
B | Mg,0.1 mol | 3mol·L-1 鹽酸10mL | 60℃ |
C | Fe,0.1 mol | 3mol·L-1L鹽酸10mL | 60℃ |
D | Mg,0.1 mol | 3mol·L-1 硫酸10mL | 60℃ |
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
將4molA氣體和2molB氣體在2 L的容器中混合,并在一定條件下發(fā)生如下反應:2A(g)+B(g)  2C(g)。若經2 s后測得C的濃度為0.6mol·L-1,現有下列幾種說法:
2C(g)。若經2 s后測得C的濃度為0.6mol·L-1,現有下列幾種說法:
①用物質A表示的反應的平均速率為0.3 mol·L-1·s-1 ;
②用物質B表示的反應的平均速率為0.6 mol·L -1·s-1;
-1·s-1;
③2s時物質A的轉化率為30% ;
④2s時物質B的濃度為1.4mol·L-1。
其中正確的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
對于可逆反應:2A(g)+2B(g) C(g)+3D(g),在不同情況下測得有下列4 種反應速率,其中反應最慢的是 ( )
C(g)+3D(g),在不同情況下測得有下列4 種反應速率,其中反應最慢的是 ( )
A.v(A)=0.45 mol·L-1·s-1 B.v(B)=0.6 mol·L-1·s-1
C.v(C)=0.3 mol·L-1·s-1 D.v(D)=0.4 mol·L-1·s-1
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
在密閉容器中A與B反應生成C,其反應速率分別用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之間有以下關系:2v(A)=3v(B), 3v(B)=2v(C)。則此反應的化學方程式可表示為( )
A.2A+3B=2C B.A+3B=2C C.3A+2B=3C D.A+B=C
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
在3個體積相同的密閉容器中均發(fā)生下列反應:CO2+H2 H2O(g)+CO,反應所處的溫度相同,但起始物質的量不同,其中甲:n(CO2)=amol,n(H2)=2amol;乙:n(CO2)=n(H2)=a mol;丙:n(CO2)=n(H2)=n(CO)=amol。達到平衡時,H2O(g)的物質的量由大到小的順序是 ( )
H2O(g)+CO,反應所處的溫度相同,但起始物質的量不同,其中甲:n(CO2)=amol,n(H2)=2amol;乙:n(CO2)=n(H2)=a mol;丙:n(CO2)=n(H2)=n(CO)=amol。達到平衡時,H2O(g)的物質的量由大到小的順序是 ( )
A.甲﹥乙﹥丙 B.甲﹥丙﹥乙 C.乙﹥甲﹥丙 D.乙﹥丙﹥甲
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
在恒容密閉容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2的平衡濃度c(CO2)與溫度T的關系如圖所示。
CO2(g)+H2(g),CO2的平衡濃度c(CO2)與溫度T的關系如圖所示。
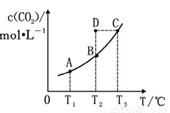
下列說法錯誤的是( )
A.反應CO(g)+H2O(g) CO2(g)+H2(g)的 ΔH﹥0
CO2(g)+H2(g)的 ΔH﹥0
B.在T2時,若反應處于狀態(tài)D,則一定有ν(正)﹥ν(逆)
C.平衡狀態(tài)A與C相比,平衡狀態(tài)A的c(CO)大
D.若T1、T2時的平衡常數分別為K1、K2, 則K1﹤K2
則K1﹤K2
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
通常人們把拆開1mol某化學鍵所吸收的能量或形成1mol某化學鍵所釋放的能量看成該化學鍵的鍵能。已知熱化學方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol
2NH3(g) ΔH=-92.4kJ/mol
化學鍵 | H | N≡N | H-N |
鍵能 | 436 kJ/mol | x | 391kJ/mol |
請根據熱化學方程式和表中數據計算N≡N鍵的鍵能x約為( )
A.431kJ/mol B.946kJ/mol C.649kJ /mol D.869kJ/mol
/mol D.869kJ/mol
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:選擇題
反應H2(g)+I2(g) 2HI(g)的平衡常數K1 ,反應HI(g)
2HI(g)的平衡常數K1 ,反應HI(g)
 H2(g)+
H2(g)+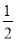 I2(g)的平衡常數K2,則K1、K2的關系為(平衡常數為同溫度下的測定值)( )
I2(g)的平衡常數K2,則K1、K2的關系為(平衡常數為同溫度下的測定值)( )
A.K1=2K2 B.K1=K22 C.K1= D.K1=
D.K1=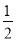 K2
K2
查看答案和解析>>
科目: 來源:2016-2017學年山東省濟寧市歷城區(qū)高二上期中化學試卷(解析版) 題型:填空題
聯(lián)合國氣候變化大會于2009年12月7~18日在哥本哈根召開。中國政府承諾到2020年,單位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“減碳”的手段之一是節(jié)能,下列制氫方法最符合這一做法的是_________(填序號)。
A.電解水制氫:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高溫使水分解制氫:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太陽光催化分解水制氫:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然氣制氫:CH4+H2O CO+3H2
CO+3H2
(2)用CO2和氫氣合成CH3OCH3(甲 醚 )是解決能源危機的研究方向之一。
已知:CO(g)+2H2(g)= CH3OH(g) △H = Q1kJ·mol-1
2CH3OH(g)= CH3OCH3(g)+H2O(g) △H = Q2kJ·mol-1
CO(g)+H2O(g)= CO2(g)+H2(g) △H = Q3kJ·mol-1
則CO2和氫氣合成CH3OCH3(g)的熱化學方程式為:____________________。
(3)在催化劑和一定溫度、壓強條件下,CO與H2可反應生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡轉化率與溫度、壓強的關系如圖所示,則:p1__________p2 (填“>”、“<”或“ = ”, 下同),該反應的△H__________
CH3OH(g),CO的平衡轉化率與溫度、壓強的關系如圖所示,則:p1__________p2 (填“>”、“<”或“ = ”, 下同),該反應的△H__________ 0 。
0 。

查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com