
科目: 來源: 題型:解答題
 某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L氫氧化鈉溶液在上圖裝置中進行中和反應.在大燒杯底部墊泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:
某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L氫氧化鈉溶液在上圖裝置中進行中和反應.在大燒杯底部墊泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:| 實驗序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫差(t2-t1)/℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目: 來源: 題型:解答題
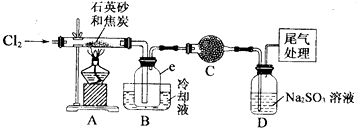
| 物質 | SiCl4 | AlCl3 | FeCl3 |
| 沸點/℃ | 57.7 | 315 | |
| 熔點/℃ | -70.0 | ||
| 升華溫度/℃ | 180 | 300 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
查看答案和解析>>
科目: 來源: 題型:解答題

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

| 離子 | 開始沉淀時的pH | 完全沉淀時的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com