
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:填空題
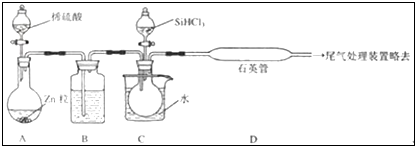
查看答案和解析>>
科目: 來源: 題型:填空題
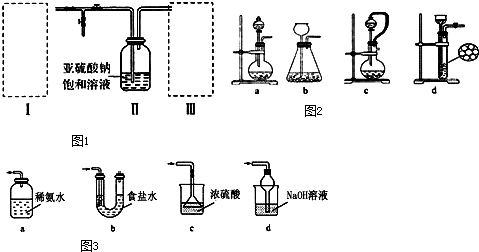
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
 某化學興趣小組擬用圖裝置制備氫氧化亞鐵并觀察其顏色.提供化學藥品:鐵屑、稀硫酸、氫氧化鈉溶液.
某化學興趣小組擬用圖裝置制備氫氧化亞鐵并觀察其顏色.提供化學藥品:鐵屑、稀硫酸、氫氧化鈉溶液.| 實驗次數 | 第一次 | 第二次 | 第三次 |
| 消耗高錳酸鉀溶液體積/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目: 來源: 題型:解答題

| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
查看答案和解析>>
科目: 來源: 題型:解答題
 高錳酸鉀是一種用途廣泛的強氧化劑,實驗室制備高錳酸鉀所涉及的化學方程式如下:MnO2熔融氧化:
高錳酸鉀是一種用途廣泛的強氧化劑,實驗室制備高錳酸鉀所涉及的化學方程式如下:MnO2熔融氧化:查看答案和解析>>
科目: 來源: 題型:解答題
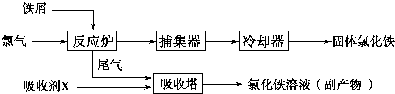
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com