
科目: 來源: 題型:解答題
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始濃度 mol/L | 2.00 | 0.50 | 0 |
| 平衡濃度 mol/L | c1 | 1.00 | c2 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | a (A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a (B)=a′(B) | ||
| C. | a (A)<a′(A) a (B)=a′(B) | D. | a (A)=a(A) a (B)>a′(B) |
查看答案和解析>>
科目: 來源: 題型:解答題
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol•L-1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:選擇題
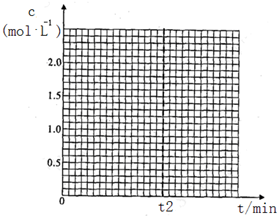
 一定溫度下,將1mol A和1mol B氣體充入2L恒容密閉容器中,發生反應A(g)+B(g)?xC(g)+D(s),t1時達到平衡.在t2、t3時刻分別改變反應的一個條件,測得容器中氣體C的濃度隨時間的變化如圖所示.下列說法正確的是( )
一定溫度下,將1mol A和1mol B氣體充入2L恒容密閉容器中,發生反應A(g)+B(g)?xC(g)+D(s),t1時達到平衡.在t2、t3時刻分別改變反應的一個條件,測得容器中氣體C的濃度隨時間的變化如圖所示.下列說法正確的是( )| A. | 反應方程式中的x=1 | |
| B. | t2時刻改變的條件是使用催化劑 | |
| C. | t3時刻改變的條件是移去少量物質D | |
| D. | t1~t3間該反應的平衡常數均為4 |
查看答案和解析>>
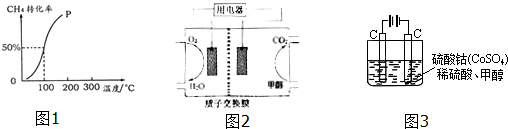
科目: 來源: 題型:選擇題
| 溫度(℃) 平衡態 | 260 | 270 | 280 | 290 | 300 | 310 |
| CO轉化率(%) | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3產率(%) | 33 | 45 | 77 | 79 | 62 | 52 |
| A. | 反應①、②均為吸熱反應 | |
| B. | 290℃時反應②K值達到最大 | |
| C. | 平衡時,反應①與②中CH3OH的消耗速率一定相等 | |
| D. | 增大壓強能增大CH3OCH3產率 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:填空題
 實驗室制備1,2-二溴乙烷的反應原理如下:
實驗室制備1,2-二溴乙烷的反應原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com