
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
 硫酸是工業(yè)生產(chǎn)中最為重要的產(chǎn)品之一,在化學(xué)工業(yè)的很多領(lǐng)域都要用到濃硫酸.
硫酸是工業(yè)生產(chǎn)中最為重要的產(chǎn)品之一,在化學(xué)工業(yè)的很多領(lǐng)域都要用到濃硫酸. | 1個大氣壓 | 5個大氣壓 | 10個大氣壓 | 15個大氣壓 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目: 來源: 題型:多選題
| A. | 硫酸工業(yè)生產(chǎn)過程在接觸室中運用熱交換技術(shù)可充分利用能源 | |
| B. | 聯(lián)合制堿法生產(chǎn)純堿時,先通入二氧化碳,再通入氨氣 | |
| C. | 氯堿工業(yè)是以利用電解食鹽水生產(chǎn)氯氣、氫氣和氫氧化鈉為基礎(chǔ)的工業(yè)體系 | |
| D. | 合成氨工業(yè)匯總,加入催化劑可提高氫氣的轉(zhuǎn)化率 |
查看答案和解析>>
科目: 來源: 題型:解答題

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態(tài) | 無色液體 | 無色液體[ | 無色液體 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | -130 | 9 | -1l6 |
查看答案和解析>>
科目: 來源: 題型:解答題
 ;
;
查看答案和解析>>
科目: 來源: 題型:填空題

查看答案和解析>>
科目: 來源: 題型:解答題
| 分子式 | 溶度積Ksp | 沉淀完全時的pH | 氯化鈷晶體的性質(zhì) |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2•6H2O呈紅色,常溫下穩(wěn)定.110~120℃時脫水變成藍色無水氯化鈷 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.1×10-36 | 3.7 |

查看答案和解析>>
科目: 來源: 題型:解答題
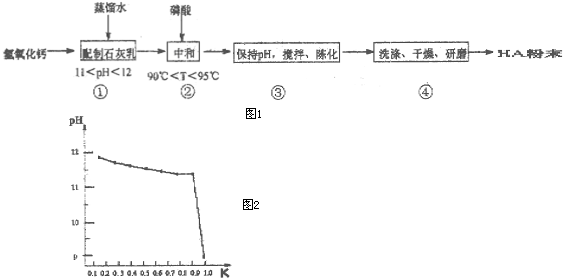
查看答案和解析>>
科目: 來源: 題型:解答題


查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com