
科目: 來源: 題型:選擇題
| A. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的核外電子數相同,是同一種核素 | |
| B. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的中子數相同,互稱為同位素 | |
| C. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的質子數相同,互稱為同位素 | |
| D. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的質量數相同,不能互稱為同位素 |
查看答案和解析>>
科目: 來源: 題型:選擇題
 如圖所示,鈉、鎂、鋁、鐵分別跟足量的氯氣反應時,消耗金屬的質量與反應的氯氣的質量之間的關系,其中表示鋁與氯氣反應的是( )
如圖所示,鈉、鎂、鋁、鐵分別跟足量的氯氣反應時,消耗金屬的質量與反應的氯氣的質量之間的關系,其中表示鋁與氯氣反應的是( )| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目: 來源: 題型:解答題
 堿式碳酸銅[Cu2(OH)2CO3]是一種用途廣泛的化工原料,實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:
堿式碳酸銅[Cu2(OH)2CO3]是一種用途廣泛的化工原料,實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:查看答案和解析>>
科目: 來源: 題型:解答題
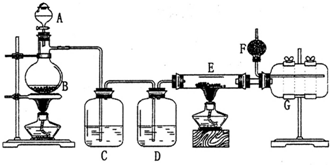
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

| 實驗步驟 | 實驗預期現象及結論 |
| 步驟一:取少量的FeSO4 固體于試管中,加入一定量水溶解 | |
| 步驟二: |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | a的值為3 | B. | 平衡時X的濃度為0.8mol/L | ||
| C. | Y的轉化率為60% | D. | 反應速率v(Y)=0.2mol/(L•min) |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:填空題
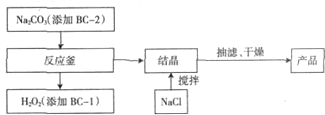
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com