
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題


查看答案和解析>>
科目: 來源: 題型:解答題

| 物質 | 開始沉淀時的pH | 完全沉淀時的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
科目: 來源: 題型:解答題

| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目: 來源: 題型:解答題

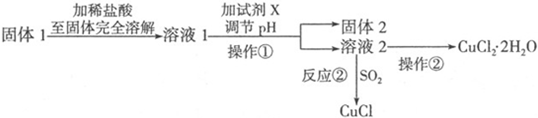
查看答案和解析>>
科目: 來源: 題型:填空題

查看答案和解析>>
科目: 來源: 題型:解答題

 ,寫出更改試劑(氣體過量)后生成沉淀E所發生反應的離子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,寫出更改試劑(氣體過量)后生成沉淀E所發生反應的離子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
科目: 來源: 題型:解答題

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl產率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |

查看答案和解析>>
科目: 來源: 題型:填空題
 硝基苯是重要的精細化工原料,是醫藥和染料的中間體制備,還可做有機溶劑.制備硝基苯的過程如下:
硝基苯是重要的精細化工原料,是醫藥和染料的中間體制備,還可做有機溶劑.制備硝基苯的過程如下:
| 物質 | 熔點/℃ | 沸點/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 難溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 濃硝酸 | / | 83 | 1.4 | 易溶于水 |
| 濃硫酸 | / | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目: 來源: 題型:解答題



查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com