
科目: 來源: 題型:選擇題
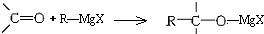 ,所得產物經水解可以得到醇,這是某些復雜醇的合成方法之一.現欲合成(CH3)3C-OH,下列所選用的鹵代烴和羰基化合物的組合正確的是( )
,所得產物經水解可以得到醇,這是某些復雜醇的合成方法之一.現欲合成(CH3)3C-OH,下列所選用的鹵代烴和羰基化合物的組合正確的是( )| A. | 乙醛和氯乙烷 | B. | 甲醛和1-溴丙烷 | C. | 甲醛和2-溴丙烷 | D. | 丙酮和一氯甲烷 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 同溫同壓下,H2+Cl2=2HCl在光照和點燃條件的△H不同 | |
| B. | 鉛蓄電池在放電過程中,負極質量減小,正極質量增加 | |
| C. | 天然氣、沼氣和水煤氣分別屬于化石能源、可再生能源和一級能源 | |
| D. | 元素原子的核外電子排布呈周期性變化是元素性質呈現周期性變化的根本原因 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 硫原子的原子結構示意圖: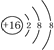 | |
| B. | 過氧化鈉的電子式: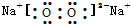 | |
| C. | 原子核內有8個質子、10個中子的氧原子:810O | |
| D. | HClO的結構式為 H-Cl-O |
查看答案和解析>>
科目: 來源: 題型:填空題
 .
.查看答案和解析>>
科目: 來源: 題型:解答題

| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

查看答案和解析>>
科目: 來源: 題型:解答題
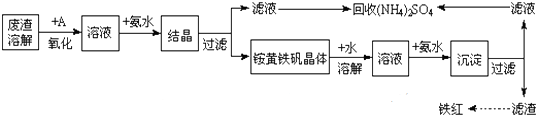
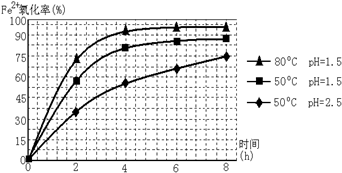
查看答案和解析>>
科目: 來源: 題型:解答題

| 物質 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 難溶 | 難溶 | 易溶 |
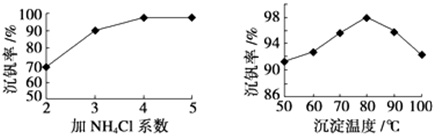
查看答案和解析>>
科目: 來源: 題型:解答題
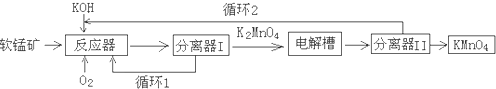
查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:解答題

| 金屬陽離子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 開始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com