
科目: 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:選擇題
下列實驗操作、現象及由此得出的結論均正確的是
選項 | 實驗操作 | 現象 | 結論 |
A | 將銅粉加入1.0 mol·L-1Fe2(SO4)3溶液中 | 銅粉溶解 | 金屬銅比鐵活潑 |
B | 將pH試紙放在玻片上,用玻璃棒蘸取某新制氯水,點在pH試紙中央,與標準比色卡對照 | pH=2 | 氯氣與水反應生成了強酸 |
C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再調溶液的pH約為5 | 有紅褐色沉淀生成 | Fe2+被H2O2氧化為Fe3+ |
D | 將KI和FeCl3溶液在試管中混合后,加入汽油,振蕩,靜置 | 下層溶液顯紫紅色 | 生成的I2全部溶于汽油中 |
查看答案和解析>>
科目: 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:填空題
查閱資料:元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4?(綠色)、Cr2O72?(橙紅色)、CrO42?(黃色)等形式存在,Cr(OH)3為難溶于水的灰藍色固體,回答下列問題:
(1)鉻(24Cr)屬于_______________(選填編號)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.過渡元素
(2)鉻單質是銀白色有金屬光澤的固體,有較高的熔點,是最硬的金屬;與Ni等添加到Fe中可制成不銹鋼。比較硬度:純鐵_________不銹鋼;熔點:純鐵__________不銹鋼(填“>”“<”或“=”)。
(3)Cr(OH)3與Al(OH)3的化學性質相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至過量,可觀察到的現象是___________________。
(4)CrO42?和Cr2O72?在溶液中可相互轉化。室溫下,初始濃度為1.0 mol·L?1的Na2CrO4溶液中c(Cr2O72?)隨c(H+)的變化如圖所示。
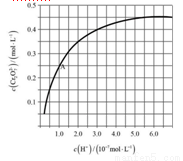
①用離子方程式表示Na2CrO4溶液中的轉化反應____________________。
②由圖可知,溶液酸性增大,CrO42?的平衡轉化率__________(填“增大”“減小”或“不變”)。根據A點數據,計算出該轉化反應的平衡常數為__________。
③升高溫度,溶液中CrO42?的平衡轉化率減小,則該反應的ΔH__________0(填“>”“<”或“=”)。
(5)+6價鉻的化合物毒性較大,但其化合物用途廣泛。如:“酒精檢測儀”可檢查司機是否酒駕,其反應原理為:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化學式最有可能為__________。常用NaHSO3將酸性廢液中的Cr2O72?還原成Cr3+,該反應的離子方程式為_______________。
查看答案和解析>>
科目: 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:實驗題
某化學興趣小組同學展開對漂白劑亞氯酸鈉(NaClO2)的研究。
實驗Ⅰ. 制取NaClO2晶體
已知:NaClO2飽和溶液在溫度低于38℃時析出的晶體是NaClO2·3H2O,高于38℃時析出的晶體是NaClO2,高于60 ℃時NaClO2分解成NaClO3和NaCl。現利用下圖所示裝置進行實驗。
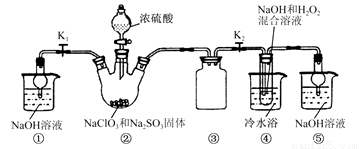
(1) 裝置②中產生ClO2氣體的化學方程式為 ;
裝置④中制備NaClO2的化學方程式為 。
(2) 裝置③的作用是 。
(3) 從裝置④反應后的溶液獲得NaClO2晶體的操作步驟如下:
①減壓,55℃蒸發結晶;②趁熱過濾;③ ;④低于60 ℃干燥,得到成品。
實驗II. 測定某亞氯酸鈉樣品的純度
設計如下實驗方案,并進行實驗:
①稱取所得亞氯酸鈉樣品m g于燒杯中,加入適量蒸餾水和過量的碘化鉀晶體,再滴入適量的稀硫酸,充分反應(已知:ClO2?+4I?+4H+==2H2O+2I2+Cl?);將所得混合液配成250 mL待測溶液。
②移取25.00 mL待測溶液于錐形瓶中,加幾滴淀粉溶液,用c mol·L?1 Na2S2O3標準液滴定,至滴定終點。重復2次,測得平均值為V mL(已知:I2+2S2O32?=2I?+S4O62?)。
(4) 達到滴定終點時的現象為 。
(5) 該樣品中NaClO2的質量分數為 (用含m、c、V的代數式表示)。
(6) 在滴定操作正確無誤的情況下,此實驗測得結果偏高,原因用離子方程式表示為 。
查看答案和解析>>
科目: 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:實驗題
2Zn(OH)2·ZnCO3是制備活性ZnO的中間體,以鋅焙砂(主要成分為ZnO,含少量Cu2、Mn2+等離子)為原料制備2Zn(OH)2·ZnCO3的工藝流程如下:
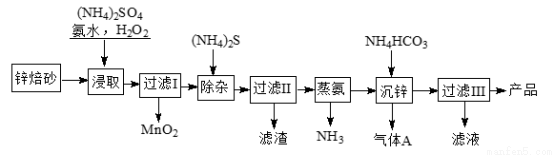
請回答下列問題:
(1)當(NH4)2SO4、NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42?)時,溶液呈 (填“酸”、“堿”或“中”)性。
(2)“浸取”時為了提高鋅的浸出率,可采取的措施是 (任寫兩種)。
(3)“浸取”時加入的NH3·H2O過量,生成MnO2的離子方程式為 。
(4)適量S2?能將Cu2+硫化物沉淀而除去,若選擇ZnS進行除雜,是否可行?用計算說明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36;一般認為反應的平衡常數K>105,該反應進行基本完全。]
(5)“沉鋅”的離子方程式為___________________。
(6)上述流程中多次需要過濾,實驗室進行過濾操作需要用到的玻璃儀器有__________。“過濾III”所得濾液可循環使用,產品需洗滌干燥后備用,檢驗產品洗滌干凈的操作和現象是_______________。
查看答案和解析>>
科目: 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:填空題
【化學—選修3:物質結構與性質】人類在使用金屬的歷史進程中,經歷了銅、鐵、鋁之后,第四種將被廣泛應用的金屬被科學家預測是鈦(Ti),它被譽為“未來世紀的金屬”.試回答下列問題:

(1)Ti元素原子序數為22,它在元素周期表中的位置是第 周期第 族;其基態原子的電子排布式為 。
(2)在Ti的化合物中,可以呈現+2、+3、+4三種化合價,其中以+4價的Ti最為穩定.偏鈦酸鋇的熱穩定性好,介電常數高,在小型變壓器、話筒和擴音器中都有應用.偏鈦酸鋇晶體中晶胞的結構示意圖如圖1所示,它的化學式是 ,其中Ti4+的氧配位數為 ,Ba2+的氧配位數為 。
(3)常溫下的TiCl4是有刺激性臭味的無色透明液體,熔點﹣23.2℃,沸點136.2℃,所以TiCl4應是
化合物,其固體是 晶體。TiCl4在潮濕空氣中易揮發,水解而冒白煙,這是因為水解后有 生成。
(4)已知Ti3+可形成配位數為6的配合物,其空間構型為正八面體,如圖2所示,我們通常可以用圖3所示的方法來表示其空間構型(其中A表示配體,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空間構型也為八面體型,它有 種同分異構體,請將其結構畫出_________________。
查看答案和解析>>
科目: 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:推斷題
【化學——選修5:有機化學基礎】部分果蔬中含有下列成分:
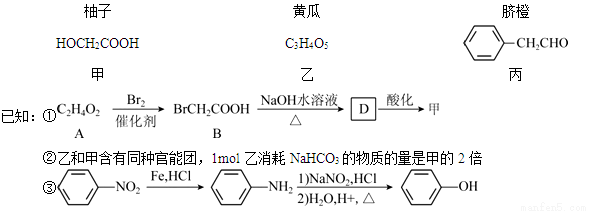
回答下列問題:
(1)甲可由已知①得到。
①甲中含有不飽和鍵的官能團名稱為 ,可以表征有機化合物中存在何種官能團的儀器是 。
②A→B為取代反應,A的結構簡式為 。
③B→D的化學方程式為 。
(2)乙在一定條件下能聚合生成鏈狀酯類有機高分子化合物,該反應的化學方程式為_____________。
(3)由丙經下列途徑可得一種重要的醫藥和香料中間體J(部分反應條件略去):

檢驗丙中官能團的試劑是 ,反應的現象是________________。
②經E→G→H保護的官能團是 ,據此推出E→G兩步反應略去的反應物可能為:第一步__________________,第二步____________________。
③J有多種同分異構體。其中某異構體L呈鏈狀且不存在支鏈,L中的官能團都能與H2 發生加成反應,L在核磁共振氫譜上顯示為兩組峰,峰面積比為3:2,則L的結構簡式為___________(只寫一種)。
查看答案和解析>>
科目: 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
化學與生活密切相關,下列有關說法錯誤的是( )
A.用灼燒的方法可以區分蠶絲和人造纖維
B.食用油反復加熱不會產生稠環芳香烴等有害物質
C.加熱能殺死流感病毒是因為蛋白質受熱變性
D.醫用消毒酒精中乙醇的濃度為75%
查看答案和解析>>
科目: 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.常溫常壓下,22.4 L乙烯中C—H鍵數為4 NA
B.1 mol羥基中電子數為10 NA
C.在反應KIO3 + 6 HI = KI + 3 I2 + 3 H2O中,每生成3 mol I2轉移的電子數為6 NA
D.常溫下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子數為0.2 NA
查看答案和解析>>
科目: 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
下列實驗方法或裝置正確的是( )

A. 用圖1所示裝置制取乙烯
B. 用圖2所示方法驗證HCl氣體易溶于水
C. 用圖3所示方法探究固體表面積對反應速率的影響
D. 用圖4所示方法檢驗溴乙烷與NaOH醇溶液共熱產生乙烯
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com