
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:實驗題
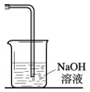 實驗室常用以下方法制取氯氣:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答
實驗室常用以下方法制取氯氣:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答查看答案和解析>>
科目: 來源: 題型:推斷題

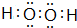 .
.查看答案和解析>>
科目: 來源: 題型:填空題
| 熔點/K | 沸點/K | 標準狀況時在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
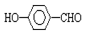 的沸點比
的沸點比 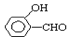 高,原因是:
高,原因是: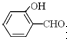 形成分子內氫鍵,而
形成分子內氫鍵,而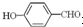 形成分子間氫鍵,分子間氫鍵使分子間作用力增大.
形成分子間氫鍵,分子間氫鍵使分子間作用力增大.查看答案和解析>>
科目: 來源: 題型:解答題
 .
.查看答案和解析>>
科目: 來源: 題型:計算題
查看答案和解析>>
科目: 來源: 題型:解答題
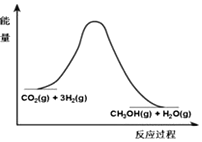 由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引用了各界的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),該反應的能量變化如圖所示:
由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引用了各界的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),該反應的能量變化如圖所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目: 來源: 題型:實驗題
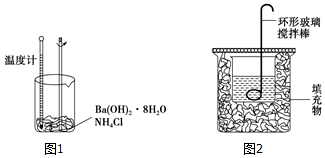
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com