
科目: 來源: 題型:實驗題
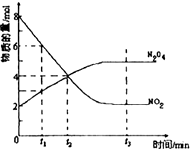 一定溫度下,在容積為1L的密閉容器中放入2molN2O4和8molNO2,發生如下反應2NO2(紅棕色)═N2O4(無色)△H<0反應中NO2、N2O4的物質的量隨反應時間變化的曲線如圖,按下列要求作答:
一定溫度下,在容積為1L的密閉容器中放入2molN2O4和8molNO2,發生如下反應2NO2(紅棕色)═N2O4(無色)△H<0反應中NO2、N2O4的物質的量隨反應時間變化的曲線如圖,按下列要求作答:查看答案和解析>>
科目: 來源: 題型:實驗題
查看答案和解析>>
科目: 來源: 題型:多選題
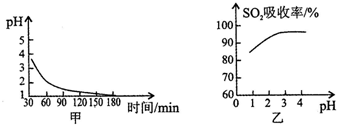
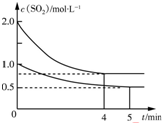 向甲、乙兩個容積均為1L的恒溫恒容的密閉容器中,分別充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),發生反應:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段時間后達到平衡,測得兩容器中c(SO2)(mol•L-1)隨時間t(min)的變化關系如圖所示.下列說法正確的是( )
向甲、乙兩個容積均為1L的恒溫恒容的密閉容器中,分別充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),發生反應:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段時間后達到平衡,測得兩容器中c(SO2)(mol•L-1)隨時間t(min)的變化關系如圖所示.下列說法正確的是( )| A. | 放出的熱量Q:Q(甲)>2Q(乙) | |
| B. | 體系總壓強p:p(甲)>2p(乙) | |
| C. | 乙中前5 min內的反應速率v(O2)=0.05mol•L-1•min-1 | |
| D. | 保持其他條件不變,若起始時向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,則此時v(正)>v(逆) |
查看答案和解析>>
科目: 來源: 題型:實驗題

查看答案和解析>>
科目: 來源: 題型:解答題
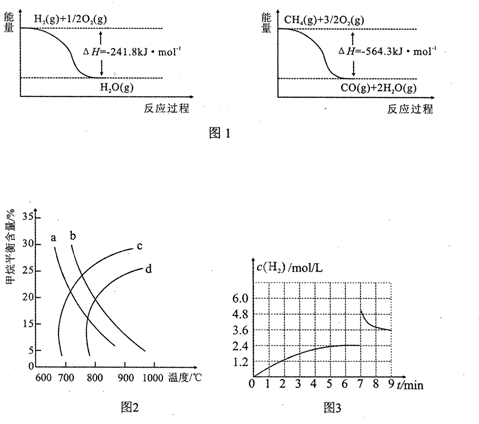
 2SO2(g)+2O2(g)?2SO3(g)是生產硫酸的主要反應之一.下表是原料氣按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa時,不同溫度下SO2的平衡轉化率.
2SO2(g)+2O2(g)?2SO3(g)是生產硫酸的主要反應之一.下表是原料氣按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa時,不同溫度下SO2的平衡轉化率.| 溫度/ | 400 | 500 | 600 |
| SO2轉化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
科目: 來源: 題型:解答題
 從海帶中提取單質碘及碘的化合物間的轉化關系如圖所示:
從海帶中提取單質碘及碘的化合物間的轉化關系如圖所示:
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | a:b=3:1 | |
| B. | X、Y的轉化率相等 | |
| C. | Y和Z的生成速率之比為2:3可做平衡標志 | |
| D. | a的取值范圍為0 mol•L-1<a<0.18 mol•L-1 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題

| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/mol•L-1 | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
科目: 來源: 題型:解答題
 以高純H2為燃料的質子交換膜燃料電池具有能量效率高、無污染等優點,但燃料中若混有CO將顯著縮短電池壽命.以甲醇為原料制取高純H2是重要研究方向.
以高純H2為燃料的質子交換膜燃料電池具有能量效率高、無污染等優點,但燃料中若混有CO將顯著縮短電池壽命.以甲醇為原料制取高純H2是重要研究方向.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com