
科目: 來源: 題型:解答題
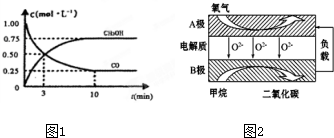
查看答案和解析>>
科目: 來源: 題型:解答題
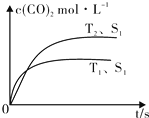 2013年霧霾天氣多次肆虐我國中東部地區(qū).其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.
2013年霧霾天氣多次肆虐我國中東部地區(qū).其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.| 溫度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 時間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
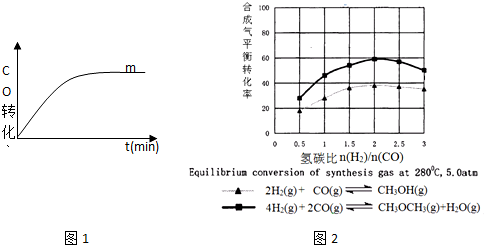
科目: 來源: 題型:解答題
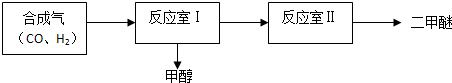
| 序號 | 溫度(°C) | 起始濃度(mol•L-1) | 平衡濃度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
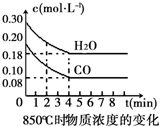 在一體積為10L的容器中,通入一定量的CO和H2O(g),在850℃時發(fā)生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)濃度變化如圖
在一體積為10L的容器中,通入一定量的CO和H2O(g),在850℃時發(fā)生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)濃度變化如圖| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 物質 | X | Y | Z | Q |
| 時間 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
科目: 來源: 題型:解答題
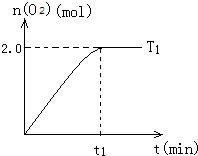 一定溫度下,在2L密閉容器中加入納米級Cu2O并通入10.0mol水蒸氣,發(fā)生反應:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1溫度下不同時段產生O2的量,見表:
一定溫度下,在2L密閉容器中加入納米級Cu2O并通入10.0mol水蒸氣,發(fā)生反應:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1溫度下不同時段產生O2的量,見表:| 時間/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
查看答案和解析>>
科目: 來源: 題型:解答題
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com