
科目: 來源: 題型:解答題
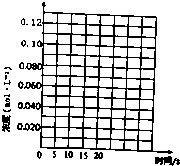 一定溫度下,在三個體積都為2L的恒容密閉容器中發生反應:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定溫度下,在三個體積都為2L的恒容密閉容器中發生反應:2CH3OH(g)?CH3OCH3(g)+H2O(g)| 容器編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 常溫下,NO分解產生O2的反應平衡常數表達式為K1=[N2][O2] | |
| B. | 常溫下,水分解產生O2,此時平衡常數的數值約為5×10-80 | |
| C. | 常溫下,NO、H2O、CO2三種化合物分解放出O2的傾向由大到小的順序為NO>H2O>CO2 | |
| D. | 以上說法都不正確 |
查看答案和解析>>
科目: 來源: 題型:解答題
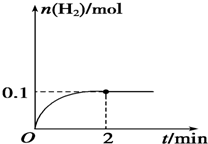
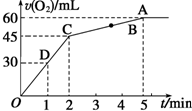 加入0.1mol MnO2粉末于50mL過氧化氫溶液(ρ=1.1g•mL-1)中,在標準狀況下放出氣體的體積和時間的關系如圖所示.
加入0.1mol MnO2粉末于50mL過氧化氫溶液(ρ=1.1g•mL-1)中,在標準狀況下放出氣體的體積和時間的關系如圖所示.查看答案和解析>>
科目: 來源: 題型:解答題
| 溫度/℃ | 200 | 250 | 300 | 350 |
| 平衡常數K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目: 來源: 題型:解答題
 (1)已知在2L的容器中進行下列可逆反應,各物質的有關數據如下:
(1)已知在2L的容器中進行下列可逆反應,各物質的有關數據如下:| 起始物質的量濃度(mol/L) | 1.5 | 1 | 0 |
| 2s末物質的量濃度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目: 來源: 題型:多選題
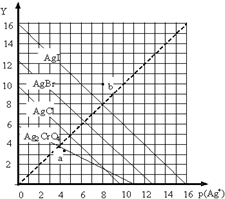 一定溫度下,鹵化銀AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲線如圖示.橫坐標p(Ag+)表示“-lgc(Ag+)”,縱坐標Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列說法正確的是( )
一定溫度下,鹵化銀AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲線如圖示.橫坐標p(Ag+)表示“-lgc(Ag+)”,縱坐標Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列說法正確的是( )| A. | a點表示c(Ag+)=c(CrO42-) | |
| B. | b點可表示AgI的飽和溶液 | |
| C. | 該溫度下AgI的Ksp約為1×10-16 | |
| D. | 該溫度下AgCl、AgBr飽和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目: 來源: 題型:解答題
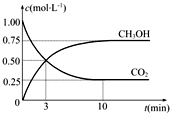 “低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:
“低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:查看答案和解析>>
科目: 來源: 題型:解答題
 硫-碘循環分解水制氫主要涉及下列反應:
硫-碘循環分解水制氫主要涉及下列反應:查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com