
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 在水中加入少量ZnSO4固體時,水的電離平衡向正反應方向移動,Kw減小 | |
| B. | 在ZnSO4溶液中各離子的濃度關系為:2c(Zn2+)+c(H+)═c(OH-)+2c(SO42-) | |
| C. | 在0.5 L 0.10 mol•L-1的ZnSO4溶液中加入等體積的0.02 mol•L-1的AgNO3溶液,即可生成Ag2SO4沉淀 | |
| D. | 常溫下,要除去0.20 mol•L-1 ZnSO4溶液中的Zn2+,至少要調節pH≥8 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:選擇題
| 化學式 | AgCl | Ag2CrO4 | CH3COOH | HC1O | H2CO3 |
| KSp 或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10 -5 | Ka=3.0×10-8 | Ka1=4.1×10一7 Ka2=5.6×10-11 |
| A. | 相同濃度CH3COONa和Na2CO3的混合液中,各離子濃度的關系有:c(Na+)>c(CO32- )>c(CH3COO- ) | |
| B. | 向0.1 mol•L-1 CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此時 c(CH3COOH):c(CH3COO-)=9:5 | |
| C. | 少量碳酸氫鈉固體加入到新制的氯水中,c(HC1O)增大 | |
| D. | 向濃度均為1×10-3 mol•L-1的KC1和K2CrO4混合液中滴加1×10-3 mol•L-1 的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 溫度/K | 298 | 398 | 498 | … |
| 平衡常數(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目: 來源: 題型:解答題
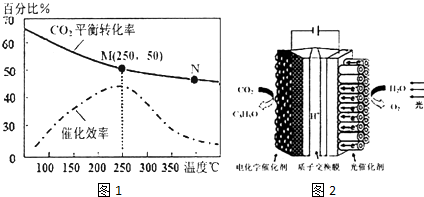
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com