
科目: 來源: 題型:選擇題
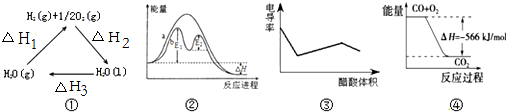
| A. | 圖①中△H2=△H1+△H3 | |
| B. | 圖②在催化劑條件下,反應的活化能等于E1+E2 | |
| C. | 圖③表示醋酸溶液滴定 NaOH 和氨水混合溶液的電導率變化曲線 | |
| D. | 圖④可表示由CO(g)生成CO2(g)的過程中要放出566kJ 熱量 |
查看答案和解析>>
科目: 來源: 題型:選擇題
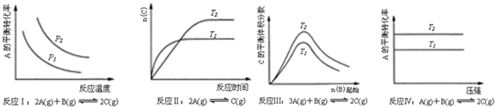
| A. | 反應Ⅰ:△H>0,P2>P1 | B. | 反應Ⅱ:△H<0,T1>T2 | ||
| C. | 反應Ⅲ:△H<0,T2>T1 | D. | 反應Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目: 來源: 題型:多選題
| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s),△H=-216kJ•mol-1,反應物總能量小于生成物總能量 | |
| B. | 相同條件下,如果1 mol氫原子所具有的能量為E1,1mol氫分子的能量為E2,則2E1>E2 | |
| C. | 101kPa時,2H2(g)+O2(g)=2H2O(1),△H=-571.6kJ•mol-1,若生成氣態水,△H小于-571.6kJ•mol-1 | |
| D. | 利用太陽能等清潔能源代替化石燃料,有利于節約資源、保護環境 |
查看答案和解析>>
科目: 來源: 題型:選擇題
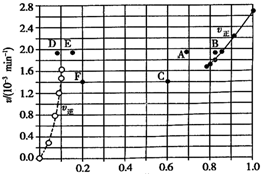 Bodensteins 研究了反應+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如表:
Bodensteins 研究了反應+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如表:| l/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高溫度到某一溫度,則再次達到平衡時,相應點 可能分別是A、E | |
| B. | 若再次充人a molHI,則達到平衡時,相應點的播坐 標值不變,縱坐標值增大 | |
| C. | 若改變的條件是增大壓強,則再次達到平衡時,相應 點與改變條件前相間 | |
| D. | 若改變的條件是使用催化劑.則再次達到平衡時,相 應點與改變條件前不間. |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量大于57.3 kJ | |
| C. | 由C(石墨)═C(金剛石)△H=1.90 kJ•mol-1可知,金剛石比石墨穩定 | |
| D. | 在100 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,則H2燃燒的熱化學方程式為2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目: 來源: 題型:解答題
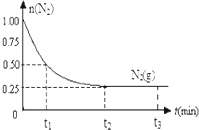 一定溫度下,在體積為2L的恒容密閉容器中充入1mol N2和3mol H2,一定條件下發生反應:N2(g)+3H2(g)?2NH3(g),測得其中N2(g)物質的量隨時間變化如圖.
一定溫度下,在體積為2L的恒容密閉容器中充入1mol N2和3mol H2,一定條件下發生反應:N2(g)+3H2(g)?2NH3(g),測得其中N2(g)物質的量隨時間變化如圖.查看答案和解析>>
科目: 來源: 題型:解答題
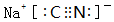 .
.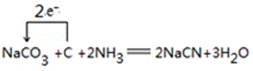 .
.查看答案和解析>>
科目: 來源: 題型:解答題
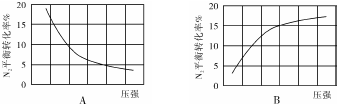
| 組別 | 溫度 | N2起始量/mol | N2的物質的量/mol | ||||||
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com