
科目: 來源: 題型:解答題
 已知酸性高錳酸鉀溶液是常用的強氧化劑,可以和草酸鈉、二氧化硫等還原性物質發生氧化還原反應.
已知酸性高錳酸鉀溶液是常用的強氧化劑,可以和草酸鈉、二氧化硫等還原性物質發生氧化還原反應.查看答案和解析>>
科目: 來源: 題型:解答題
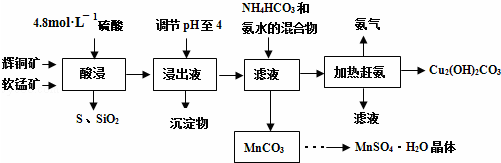
查看答案和解析>>
科目: 來源: 題型:解答題
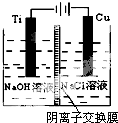 納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取Cu2O的四種方法:
納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取Cu2O的四種方法:| 方法a | 用炭粉在高溫條件下還原CuO |
| 方法b | 用葡萄糖還原新制的Cu(OH)2制備Cu2O; |
| 方法c | 電解法,反應為2Cu+H2O$\frac{\underline{\;電解\;}}{\;}$Cu2O+H2↑. |
| 方法d | 用肼(N2H4)還原新制的Cu(OH)2 |
| 序號 | 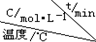 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目: 來源: 題型:解答題
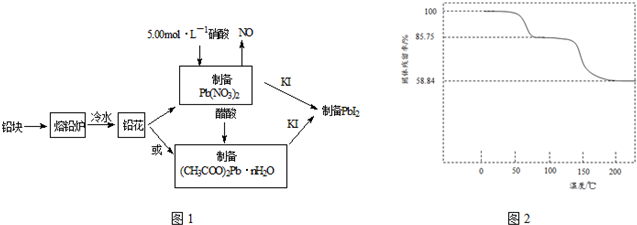
| 實驗內容 | 實驗方法 | 實驗現象及原因分析 |
| ①磺離子濃度增大對平衡的影響 | 取PbI2飽和溶液少量于一支試管中,再滴入幾滴NaI飽和溶液 | 現象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②鉛離子濃度減小對平衡的影響 | 取PbI2懸濁液少量于一支試管中,再加入少量NaCl飽和溶液 | 現象:黃色渾濁消失 原因:形成PbCl42-,導致溶液中c(Pb2+)減小,使Qc小于PbI2的Ksp |
| ③鉛離子和碘離子濃度都減小對平衡的影響 | 在PbI2懸濁液中滴入幾滴FeCl3 飽和溶液 | 現象:黃色渾濁消失 寫出反應的離子方程式: PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
查看答案和解析>>
科目: 來源: 題型:解答題
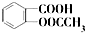 )是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.
)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.
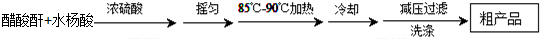
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水 |
| 水楊酸 | 138 | 158(熔點) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸點) | 易水解 |
| 乙酰水楊酸 | 180 | 135(熔點) | 微溶 |
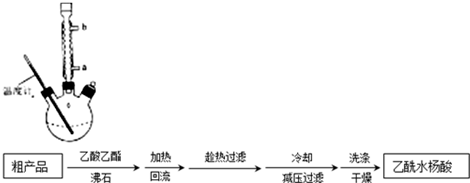
查看答案和解析>>
科目: 來源: 題型:解答題
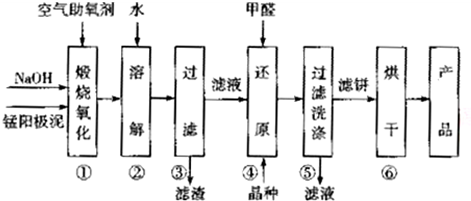
| 物質 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 難溶 |
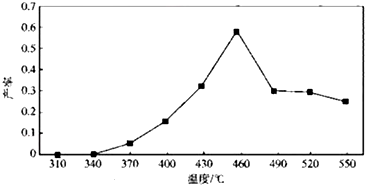
查看答案和解析>>
科目: 來源: 題型:解答題
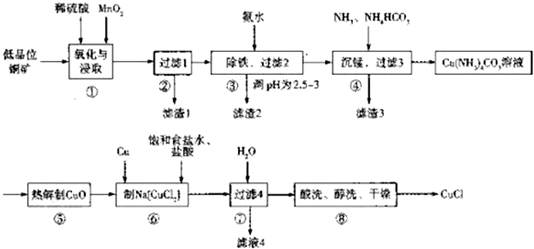
 .
.查看答案和解析>>
科目: 來源: 題型:解答題
 1-溴丙烷常用作有機反應的溶劑.實驗室制備1-溴丙烷(CH3CH2CH2Br)的反應和主要實驗裝置如下:
1-溴丙烷常用作有機反應的溶劑.實驗室制備1-溴丙烷(CH3CH2CH2Br)的反應和主要實驗裝置如下:| 相對分 子質量 | 密度 /g•mL-1 | 沸點/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 幾乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
科目: 來源: 題型:解答題
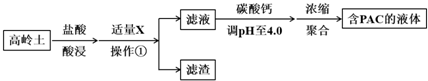
| Al(OH)3 | Fe(OH)3 | |
| 開始沉淀時 | 3.4 | 1.5 |
| 完全沉淀時 | 4.7 | 2.8 |

查看答案和解析>>
科目: 來源: 題型:解答題
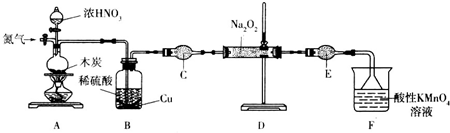
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com