
科目: 來源: 題型:解答題
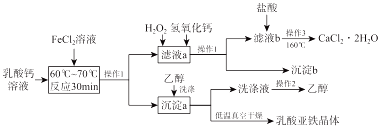
查看答案和解析>>
科目: 來源: 題型:解答題
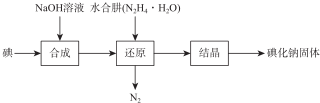
| 測定 序號 | 待測液體積/mL | 標準液滴定管起點讀數/mL | 標準液滴定管終點讀數/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目: 來源: 題型:實驗題

| 物質 | 熔點/℃ | 沸點/℃ | 溶解性 |
| 乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于熱水 |
| 苯胺 | -6 | 184.4 | 微溶于水 |
| 醋酸 | 16.6 | 118 | 易溶于水 |
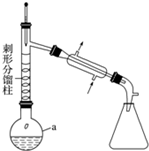
查看答案和解析>>
科目: 來源: 題型:解答題
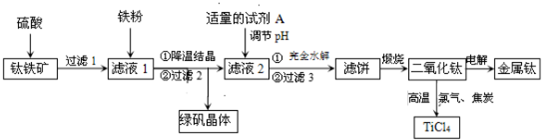
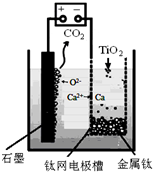
查看答案和解析>>
科目: 來源: 題型:解答題
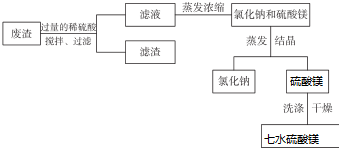
查看答案和解析>>
科目: 來源: 題型:實驗題
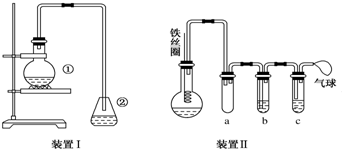
 .②中離子方程式為Br-+Ag+═AgBr↓.
.②中離子方程式為Br-+Ag+═AgBr↓. 與Br2,要想得到純凈的產物,可用NaOH溶液試劑洗滌.洗滌后分離粗產品應使用的儀器是分液漏斗.
與Br2,要想得到純凈的產物,可用NaOH溶液試劑洗滌.洗滌后分離粗產品應使用的儀器是分液漏斗.查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
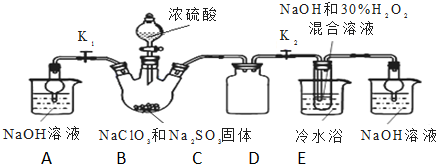
查看答案和解析>>
科目: 來源: 題型:解答題
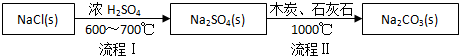
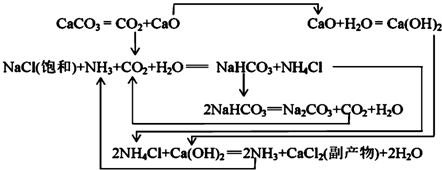
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
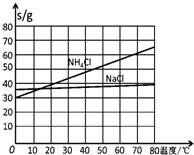
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com