
科目: 來源: 題型:解答題
| 物質 溫度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
查看答案和解析>>
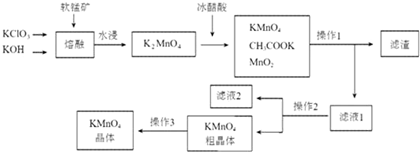
科目: 來源: 題型:實驗題
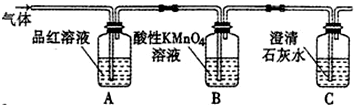
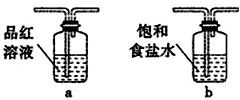
查看答案和解析>>
科目: 來源: 題型:解答題
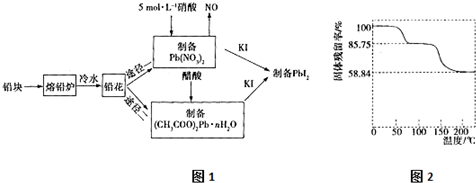
查看答案和解析>>
科目: 來源: 題型:解答題
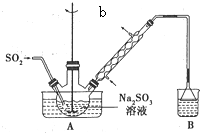 次硫酸氫鈉甲醛(aNaHSO2•bHCHO•cH2O)俗稱吊白塊,有較強的還原性.它常溫下比較穩定,在120℃以上分解成亞硝酸鹽.以Na2SO3、SO2、HCHO和鋅粉為原料可制備次硫酸氫鈉甲醛.實驗步驟如下:
次硫酸氫鈉甲醛(aNaHSO2•bHCHO•cH2O)俗稱吊白塊,有較強的還原性.它常溫下比較穩定,在120℃以上分解成亞硝酸鹽.以Na2SO3、SO2、HCHO和鋅粉為原料可制備次硫酸氫鈉甲醛.實驗步驟如下:查看答案和解析>>
科目: 來源: 題型:解答題
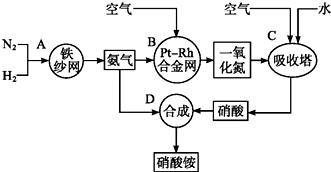
查看答案和解析>>
科目: 來源: 題型:解答題
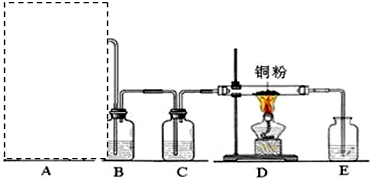
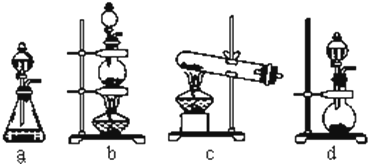
查看答案和解析>>
科目: 來源: 題型:解答題
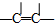 | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |

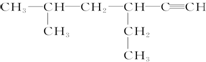
查看答案和解析>>
科目: 來源: 題型:選擇題
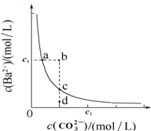
| A. | 通過蒸發可以使溶液由d點變到c點 | |
| B. | b點有BaCO3沉淀生成 | |
| C. | 升高溫度,可以使d點變為c點 | |
| D. | 在a點加入Na2CO3,達平衡時c(Ba2+)≠c(CO32-),其Ksp大于c點對應的Ksp |
查看答案和解析>>
科目: 來源: 題型:解答題
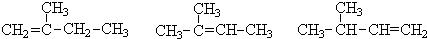
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com