
科目: 來源: 題型:填空題
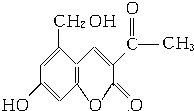 它配以輔料丙二醇溶成針劑用于臨床.假藥中使用廉價的二甘醇作為輔料,二甘醇為工業溶劑,有很強的毒性.請回答下列問題:
它配以輔料丙二醇溶成針劑用于臨床.假藥中使用廉價的二甘醇作為輔料,二甘醇為工業溶劑,有很強的毒性.請回答下列問題: .
.查看答案和解析>>
科目: 來源: 題型:解答題
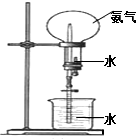 如圖所示,在干燥的圓底燒瓶里充滿氨氣,用帶有玻璃管和滴管(滴管里預先吸入水)的塞子塞緊瓶口.立即倒置燒瓶,使玻璃管插入盛有水的燒杯里(預先在水里滴入少量酚酞溶液).打開橡皮管上的夾子,輕輕擠壓滴管,使少量水進入燒瓶,可觀察到的現象為:燒杯里的水由玻璃管進入燒瓶,形成噴泉,燒瓶內液體呈紅色.
如圖所示,在干燥的圓底燒瓶里充滿氨氣,用帶有玻璃管和滴管(滴管里預先吸入水)的塞子塞緊瓶口.立即倒置燒瓶,使玻璃管插入盛有水的燒杯里(預先在水里滴入少量酚酞溶液).打開橡皮管上的夾子,輕輕擠壓滴管,使少量水進入燒瓶,可觀察到的現象為:燒杯里的水由玻璃管進入燒瓶,形成噴泉,燒瓶內液體呈紅色.查看答案和解析>>
科目: 來源: 題型:填空題
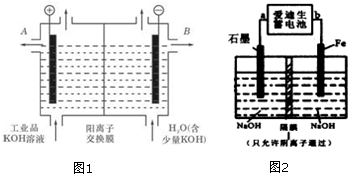
查看答案和解析>>
科目: 來源: 題型:解答題
 在元素周期表前四周期中原子序數依次增大的六種元素A、B、C、D、E、F中,A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C的氧化物是導致酸雨的主要物質之一,D原子核外電子有8種不同的運動狀態,E的基態原子在前四周期元素的基態原子中單電子數最多,F元素的基態原子最外能層只有一個電子,其它能層均已充滿電子.
在元素周期表前四周期中原子序數依次增大的六種元素A、B、C、D、E、F中,A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C的氧化物是導致酸雨的主要物質之一,D原子核外電子有8種不同的運動狀態,E的基態原子在前四周期元素的基態原子中單電子數最多,F元素的基態原子最外能層只有一個電子,其它能層均已充滿電子. ; A2D由液態形成晶體時密度減小(填增大,不變或減小),分析主要原因(用文字敘述)水形成晶體時,每個水分子與4個水分子形成氫鍵,構成空間正四面體網狀結構,水分子空間利用率低,密度反而減小
; A2D由液態形成晶體時密度減小(填增大,不變或減小),分析主要原因(用文字敘述)水形成晶體時,每個水分子與4個水分子形成氫鍵,構成空間正四面體網狀結構,水分子空間利用率低,密度反而減小查看答案和解析>>
科目: 來源: 題型:解答題
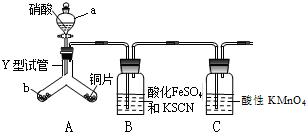 為探究銅與6mol•L-1硝酸反應的氣態產物中是否含NO2,進行如下實驗.
為探究銅與6mol•L-1硝酸反應的氣態產物中是否含NO2,進行如下實驗.查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 在常溫下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1鹽酸滴定.當滴定到消耗20mlHCl時所得溶液中離子濃度間的關系有:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常溫下,pH=12的氨水與pH=2的鹽酸等體積混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃時,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常溫下,等濃度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目: 來源: 題型:解答題
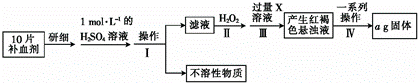
查看答案和解析>>
科目: 來源: 題型:解答題
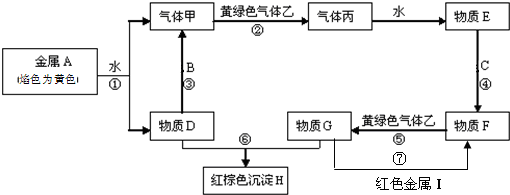
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 1 mol•L-1AlCl3溶液 | ||
| C. | 75 mL 2 mol•L-1CaCl2溶液 | D. | 200 mL 2 mol•L-1 KCl溶液 |
查看答案和解析>>
科目: 來源: 題型:解答題
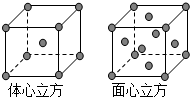 Mn、Fe均為第四周期過渡元素,兩元素的部分電離能數據列于下表:
Mn、Fe均為第四周期過渡元素,兩元素的部分電離能數據列于下表:| 元 素 | Mn | Fe | |
| 電離能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com