
科目: 來源: 題型:解答題
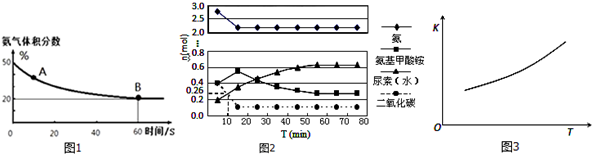
查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:選擇題
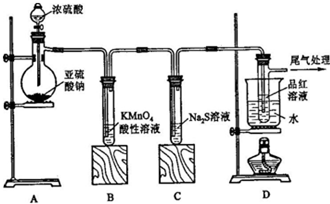
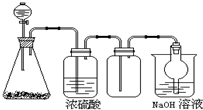 如圖是一套實驗室制氣裝置,用于發生、干燥、收集和吸收有毒氣體.下列各組物質能利用這套裝置進行實驗的是( )
如圖是一套實驗室制氣裝置,用于發生、干燥、收集和吸收有毒氣體.下列各組物質能利用這套裝置進行實驗的是( )| A. | MnO2和濃鹽酸 | B. | Na2SO3(s)和濃H2SO4 | ||
| C. | 鐵片和濃鹽酸 | D. | 電石和水 |
查看答案和解析>>
科目: 來源: 題型:解答題
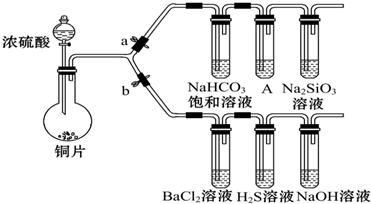
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化學式 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 不變 | B. | 增大 | C. | 減小 | D. | 無法判斷 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
| HI體積分數 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 條件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 條件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com