
科目: 來源: 題型:解答題
| T/℃ | 30 | 40 | 50 |
| 生成 NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
| 溫度/℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目: 來源: 題型:解答題
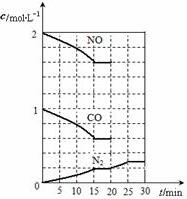 隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.
隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.查看答案和解析>>
科目: 來源: 題型:解答題
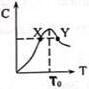 將物質的量均為3.00mol物質A、B混合于L容器中,發生如下反應3A+B?2C,再反應過程中C的物質的量分數隨溫度變化如圖所示:
將物質的量均為3.00mol物質A、B混合于L容器中,發生如下反應3A+B?2C,再反應過程中C的物質的量分數隨溫度變化如圖所示:查看答案和解析>>
科目: 來源: 題型:解答題
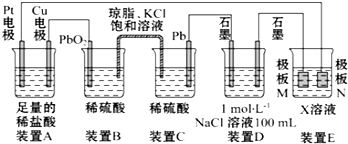
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | +30.0kJ?mol-1 | B. | -80.5kJ?mol-1 | C. | -30.0kJ?mol-1 | D. | +80.5kJ?mol-1 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-Q1 2H2(g)+O2(g)═2H2O(l)△H=-Q2 | |
| B. | S(g)+O2(g)═SO2(g)△H=-Q1 S(s)+O2(g)═SO2(g)△H=-Q2 | |
| C. | C(s)+O2(g)═CO2(g)△H=-Q1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-Q2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-Q2 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:解答題
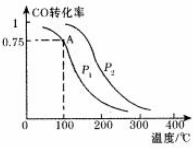 CO、SO2是主要的大氣污染氣體,利用化學反應原理是治理污染的重要方法.
CO、SO2是主要的大氣污染氣體,利用化學反應原理是治理污染的重要方法.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com