
科目: 來源: 題型:解答題
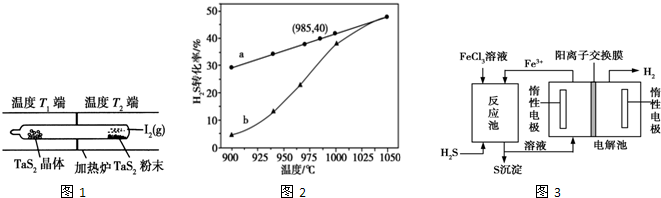
查看答案和解析>>
科目: 來源: 題型:解答題
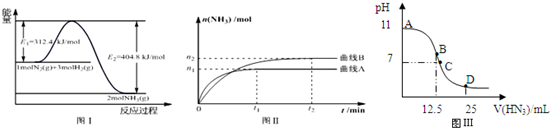
| 溫度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目: 來源: 題型:解答題
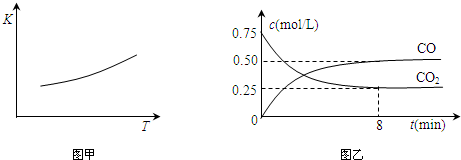
查看答案和解析>>
科目: 來源: 題型:解答題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
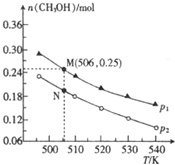 以天然氣為原料合成甲醇常見的方法有水煤氣法和目前正在開發的直接氧化法.
以天然氣為原料合成甲醇常見的方法有水煤氣法和目前正在開發的直接氧化法.查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
 2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com