
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:選擇題
一定溫度下,可逆反應2NO2  2NO+O2在體積固定的密閉容器中反應,達到平衡狀態的標志是( )
2NO+O2在體積固定的密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n mol O2,同時生成2n mol NO2、
②混合氣體的壓強不再改變
③混合氣體的平均相對分子質量不再改變
④單位時間內生成n mol O2,同時生成2n mol NO
⑤混合氣體的顏色不再改變
⑥用NO2、NO、O2的物質的量濃度變化表示的反應速率的比為2:2:1
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
查看答案和解析>>
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:選擇題
某固體酸燃料電池以CaHSO4固體為電解質傳遞H+,其基本結構見右圖,電池總反應可表示為:2H2 + O2 == 2H2O,下列有關說法不正確的是( )

A.電子通過外電路從a極流向b極
B.b極上的電極反應式為:O2+4H++4e-==2H2O
C.每轉移0.1mol電子,消耗1.12L的H2
D.H+由a極通過固體酸電解質傳遞到b極
查看答案和解析>>
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:選擇題
0.64g銅投入一定量濃HNO3中,銅完全溶解,生成氣體顏色越來越淺,共收集到224mL氣體(標況下)。將盛有此氣體的容器倒扣在水中,通入標況下一定體積的O2,恰好使氣體完全溶于水中,則通入O2的體積是( )
A.504mL B.112mL C.336mL D.224mL
查看答案和解析>>
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:填空題
(1)甲醇(CH3OH)是一種重要的化工原料。已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ; △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △H =-566.00 kJ·mol-1
H2O(1) = H2O (g) ; △H = + 44.00 kJ·mol-1
①試寫出能表示CH3OH(1)燃燒熱的熱化學方程式: 。試利用熱化學方程式計算,完全燃燒16g甲醇生成CO2和H2O(l)時,放出的熱量為 kJ
②科研人員新近開發出一種由甲醇和氧氣以強堿做電解質溶液的新型手機電池。據此回答下列問題:氧氣在 極反應;通入甲醇的電極反應式為_________________
(2)如圖所示,800℃時A、B、C三種氣體在密閉容器中反應時的濃度變化,分析圖像,回答問題:
①該反應的方程式為 。
②2min內,用B表示的反應速率為 。
③在其他條件下,測得A的反應速率為0.05mol/(L·s),此時的反應與800℃時相比, 。
A.比800℃時快 B.比800℃時慢
C.和800℃時速率一樣 D.無法比較
查看答案和解析>>
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:填空題
(1)某透明溶液僅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4種離子,所含離子均為1mol。若向該溶液中加入過量的稀硫酸,有氣泡產生,且溶液中陰離子種類不變(不考慮水的電離和離子的水解)。回答下列問題:
①溶液中存在的離子是 ;
②寫出溶液中加入過量的稀硫酸反應的離子方程式 ;
(2)CNO- 在酸性條件下與NaClO反應生成N2、CO2、Cl2等。 寫出CNO- 在酸性條件下被NaClO氧化的離子方程式: ;
(3)酸性KMnO4、H2O2、NaClO在生產、生活、衛生醫療中常用作消毒劑,下面是對這三種氧化劑性質的探究。
①向浸泡銅片的稀鹽酸中加入H2O2后,銅片溶解,反應的化學方程式 。
②取300 mL 0.2 mol/L的KI溶液與一定量的酸性KMnO4溶液恰好反應,生成等物質的量的I2和KIO3,則消耗KMnO4的物質的量是 __________mol。
③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黃色變為淺綠色,過一會又變為棕黃色。寫出溶液先變為淺綠色的離子方程式: 。
查看答案和解析>>
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:實驗題
某學習小組在實驗室制取乙酸乙酯的主要步驟如下:
①配制2mL濃硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液
②按如圖連接好裝置并加入混合液,用小火均勻加熱3~5min
③待試管乙收集到一定量產物后停止加熱,撤出試管乙用力振蕩,然后靜置待分層
④分離出乙酸乙酯,洗滌、干燥。
回答問題:

(1)裝置中球形干燥管,除起冷凝作用外,另一重要作用是 。
(2)步驟(2)安裝好實驗裝置,加入樣品前還應檢查____________________。
(3)反應中濃硫酸的作用是 ;
寫出能表示18O位置的制取乙酸乙酯的化學方程式 。
(4)上述實驗中飽和碳酸鈉溶液的作用是(填字母) 。
A.中和乙酸并吸收乙醇
B.中和乙酸和乙醇
C.減少乙酸乙酯的溶解
D.加速酯的生成,提高其產率
(5)步驟③所觀察到的現象是 ;從試管乙中分離出乙酸乙酯的實驗操作名稱是 __________________。
查看答案和解析>>
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:填空題
(1) 烷基取代苯( )可以被酸性KMnO4溶液氧化生成
)可以被酸性KMnO4溶液氧化生成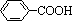 ,但若烷基R中直接與苯環連接的碳原子沒有C—H鍵,則不容易被氧化得到
,但若烷基R中直接與苯環連接的碳原子沒有C—H鍵,則不容易被氧化得到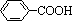 。
。
現有分子式是C11H16的烷基一取代苯,則它可以被氧化成為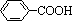 的同分異構體共有 種, 并寫出一種不能被氧化成為
的同分異構體共有 種, 并寫出一種不能被氧化成為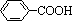 的同分異構體的結構簡式 。
的同分異構體的結構簡式 。
(2)物質A、B、C的轉化關系如圖所示:
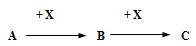
①若A 為常見金屬,C為淡黃色固體,C與水反應生成D,則D的電子式為 。
②若A分子含有10個電子且有刺激性氣味的氣體,則A的結構式為 ,寫出A生成B的反應方程式為: 。
③若A為黃綠色氣體, X為常見金屬單質,C溶液為淺綠色,則X元素在周期表中的位置 ;寫出B與X反應的化學方程式 。
查看答案和解析>>
科目: 來源:2016-2017學年河南省許昌市五校高二上學期第一次聯考化學試卷(解析版) 題型:填空題
KClO3和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯。其變化可表述為: 2KClO3 +4HCl(濃)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)請分析該反應中電子轉移的情況:(單線橋法表示)________________________。
(2)氧化劑與還原劑的物質的量之比是 ___________________
(3)若產生標況下22.4 L Cl2,則轉移的電子的物質的量為________mol。
(4)實驗室備用的濃鹽酸質量分數為36.5%,密度為1.19 g·cm-3,為使用方便,請計算出該濃鹽酸中HCl的物質的量濃度 mol·L-1。
(5)ClO2對污水中Fe2+、Mn2+、S2-和CN- 等有明顯的去除效果。某工廠污水中含CN- a mg/L,現用ClO2將CN - 氧化,只生成兩種氣體,其離子反應方程式為為 ,處理100 m3這種污水,至少需要ClO2 _______mol。
查看答案和解析>>
科目: 來源:2016-2017學年遼寧省大連市高二上9月月考化學試卷(解析版) 題型:選擇題
下列有關物質性質的說法正確的是
A. 熱穩定性:H2S>HCl B. 離子半徑:Na+>F—
C. 酸性:H2SO4>HClO4 D. 離子還原性:S2—>Cl—
查看答案和解析>>
科目: 來源:2016-2017學年遼寧省大連市高二上9月月考化學試卷(解析版) 題型:選擇題
下列描述中正確的是
A.已知:P4(白磷,s)===4P(紅磷,s)ΔH<0,則白磷比紅磷穩定
B.由CH3CH2CH2CH3(g)+13/2O2(g)===4CO2(g)+5H2O(g)ΔH=-2658 kJ·mol-1可知正丁烷的標準燃燒熱為2658 kJ·mol-1
C.OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,故1 mol醋酸與1 mol NaOH完全反應,放出的熱量為57.3 kJ·mol-1
D.已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1則2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=-746 kJ·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com