
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:選擇題
電化學氣敏傳感器可用于監測環境中NH3的含量,其工作原理示意圖如下。下列說法不正確的是( )
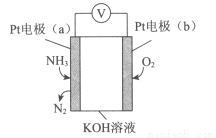
A.溶液中OH-向電極a移動
B.O2在電極b上發生還原反應
C.反應消耗的NH3與O2的物質的量之比為4:5
D.電極a的反應式為2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:選擇題
向密閉容器中,按n(CO):n(H2)=1:2充入反應物,發生反應:CO(g)+2H2(g) CH3OH(g) △H<0。L(L1、L2)、X可分別代表壓強或溫度,下圖表示L一定時,平衡混合物中CH3OH的體積分數隨X的變化關系。
CH3OH(g) △H<0。L(L1、L2)、X可分別代表壓強或溫度,下圖表示L一定時,平衡混合物中CH3OH的體積分數隨X的變化關系。

下列說法中,正確的是( )
A.X代表壓強 B.L1 <L2
C.平衡常數:K(A)=K(B) D.在C點時,CO轉化率為75%
查看答案和解析>>
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:填空題
25℃時,現有濃度均為0.10mol·L-1的兩種溶液:①CH3COOH溶液、②NaOH溶液。請回答:
(1)溶液①的pH __________(填“>”“=”或“<”)1,原因是______________。
(2)將等體積①和②混合,所得溶液顯__________(填“酸”“堿”或“中”)性,原因是__________________(用離子方程式表示)。
(3)向①中逐滴加入②至所得溶液pH=7的過程中(不含pH=7時的溶液),下列關系正確的是_________(填選項序號)。
a.c(H+)>c(OH-)
b.c(Na+)<c(CH3COO-)
C.c(Na+) =c(CH3COO-)+c(CH3COOH)
d.c(OH-) +c(CH3COO-) =c(H+) +c(Na+)
查看答案和解析>>
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:填空題
用石墨電極電解飽和NaCl溶液的裝置如下圖所示:

請回答:
(1)電解飽和NaCl溶液的總反應方程式為______________。
(2)a端是直流電源的______________(填“負”或“正”)極。
(3)陽極上發生的反應式是__________________。
(4)結合電極反應式說明電解池右側NaOH溶液濃度增大的原因是__________________。
查看答案和解析>>
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:填空題
一定溫度下,2L密閉容器中充入0.40 mol N2O4,發生反應:N2O4(g) 2NO2(g),一段時間后達到平衡,測得數據如下:
2NO2(g),一段時間后達到平衡,測得數據如下:
時間/s | 20 | 40 | 60 | 80 | 100 |
c(NO2 )/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
請回答:
(1)20 s內,v(NO2)=____________mol·L-1·s-1。
(2)升高溫度時,氣體顏色加深,則正反應是____________(填“放熱”或“吸熱”)反應。
(3)該溫度下反應的化學平衡常數數值為_____________。
(4)相同溫度下,若開始時向該容器中充入的是0.20 molN2O4和0.40molNO2,則達到平衡后,c(NO2)=_____________。
查看答案和解析>>
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:實驗題
某研究小組以銀鹽為實驗對象,研究難溶鹽時進行了如下實驗:
①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1 NaCl溶液等體積混合得到濁液a,過濾得到濾液b和白色沉淀c;
②向濾液b中滴加0.1 mol·L-1KI溶液,出現渾濁;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀變為黃色;
④向AgI中滴加0.1 mol·L-l NaCl溶液,無明顯現象。
已知:25℃時,AgCl和AgI的溶解度分別是1.5×10-4 g和3×10-7 g
請回答:
(1)沉淀c是__________。
(2)步驟②中的現象說明濾液b中含有的微粒是_________。
(3)步驟③中反應的離子方程式是__________。
(4)根據實驗,可以得出的結論是___________。
查看答案和解析>>
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:填空題
硼酸(H3BO3)為白色粉末狀結晶,大量用于玻璃工業,可以改善玻璃制品的耐熱、透明性能,提高機械強度,縮短熔融時間。以鐵硼礦(主要成分為Mg2B2O5·H2O和Fe3O4,還有少量Fe2O3、FeO、Al2O3和SiO2等)為原料制備硼酸的工藝流程如下(部分操作和條件略):
I.向鐵硼礦粉中加入過量稀H2SO4,過濾;
Ⅱ.向濾液中加入過量雙氧水,再調節溶液的pH約為5;
Ⅲ.過濾,將所得濾液蒸發濃縮、冷卻結晶、過濾得粗硼酸和含鎂鹽的母液;
Ⅳ.粗硼酸精制得硼酸。
已知:生成氫氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
開始沉淀時 | 3.8 | 5.8 | 2.2 | 10.6 |
完全沉淀時 | 4.7 | 8.3 | 4.0 | 12 |
注:金屬離子的起始濃度為0.01 mol·L-1
請回答:
(1)寫出Mg2B2O5·H2O與硫酸反應的化學方程式:___________。
(2)為提高步驟I中的反應速率,可采取的措施有_________________(寫出兩條)。
(3)步驟Ⅱ的目的是_______________________。
(4)“粗硼酸”中的主要雜質是 ___________________。
查看答案和解析>>
科目: 來源:2015-2016學年北京市東城區高二下學期期末化學試卷(解析版) 題型:填空題
二氧化硫是一種重要的化工原料,主要用于生產硫酸、亞硫酸鹽等。請回答:
(1)已知2SO2(g)+O2(g) 2SO3(g)是工業制硫酸的關鍵反應。下圖為不同溫度(T1、T2)下SO2的轉化率隨時間的變化曲線。
2SO3(g)是工業制硫酸的關鍵反應。下圖為不同溫度(T1、T2)下SO2的轉化率隨時間的變化曲線。
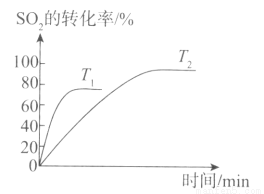
①T1__________(填“>”“<”或“=”)T2,判斷的依據是_____________________;該反應為____________(填“放”或“吸”)熱反應,判斷的依據是___________________。
②下表為一定溫度和壓強下,4種投料比[n(SO2):n(O2)]分別為2:18、4:15、7:11和8:10時SO2的平衡轉化率。
投料比 | a | b | c | d |
SO2平衡轉化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b對應的投料比為_____________。
ii.投料比為8:10時,平衡混合氣體中SO3體積分數為_________________。
(2)鈉堿循環法吸收硫酸廠尾氣中的SO2并將其轉化為硫酸的工藝如下:

①吸收池中發生反應的離子方程式是_____________________。
②電解池的構造示意圖如下:
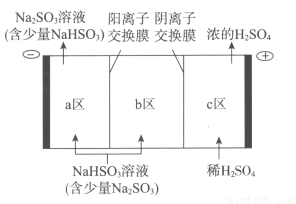
i.在圖中標示出b區的Na+和HSO3-的移動方向。
ii.請結合生成H2SO4的電極反應式說明c區除得到濃的硫酸外,還會得到什么物質:__________________。
查看答案和解析>>
科目: 來源:2015-2016學年貴州省高一下質檢化學試卷(解析版) 題型:選擇題
自然環境與人們的生活息息相關。下列有關環境問題的說法不正確的是( )
A.氟利昂(CCl2F2)因破壞大氣臭氧層而導致“溫室效應”
B.將垃圾分類并回收利用是垃圾處理的發展方向
C.廢舊電池的回收,其主要目的是保護環境,而不是回收金屬
D.淀粉餐具被認為是有發展前景的一次性餐具,可有利于保護環境
查看答案和解析>>
科目: 來源:2015-2016學年貴州省高一下質檢化學試卷(解析版) 題型:選擇題
下述實驗操作正確或能達到預期目的的是( )

A.甲圖:向容量瓶中轉移溶液 B.乙圖:實驗室制取乙酸乙酯
C.丙圖:實驗室制備NH3 D.丁圖:實驗室制備氫氧化鐵膠體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com