
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:選擇題
在一定條件下4mol乙酸與1mol葡萄糖,完全反應得到1mol葡萄糖醋酸酯,則該葡萄糖醋酸酯的分子式為
A.C14H18O10 B.C14H20O9 C.C14H20O10 D.C14H22O10
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:選擇題
下列實驗中根據現象得出的結論錯誤的是
選項 | 實驗 | 現象 | 結論 |
A | 向NaAlO2溶液中持續通入氣體Y | 先出現白色沉淀,最終沉淀又溶解 | Y可能是CO2氣體 |
B | 向某溶液中加入Cu 和濃H2SO4 | 試管口有紅棕色氣體產生 | 原溶液可能含有NO3- |
C | 將打磨過的Al片投到一定濃度的CuCl2溶液中 | 出現氣泡井有固體生成,過濾,向固體中加入過量的氨水,固體部分溶解 | Al與CuCl2溶液反應,有H2和Cu(OH)2生成 |
D | 向濃度均為0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出現藍色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:選擇題
一種三室微生物燃料電池污水凈化系統原理如右圖所示,圖中有機廢水中有機物可用C6H10O5表示。有關說法錯誤的是
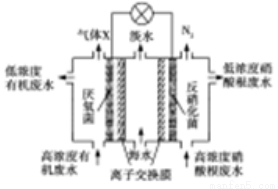
A.中間室Cl-移向左室
B.反應后將左右兩室溶液混合比反應前將兩室溶液混合的酸性強
C.氣體X為CO2
D.左邊離子交換膜為氯離子交換膜,右邊離子交換膜為鈉離子交換膜
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:選擇題
短周期元素X、Y、Z、W的原子序數依次增大。它們分別位于不同的主族,X 的最高正價與最低負價代數和為0,Y為金屬元素,Y與Z最外層電子數之和與W的最外層電子數相等,X與W所在族序數之和等于10。下列說法正確的是
A. 原子半徑大小順序:r(W)>r(Z)>r(Y)>r(X)
B. 沸點:XW2>Y2W
C. 最高價氧化物對應的水化物的酸性:X<Z
D. 簡單氫化物的熱穩定性:Z>W
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:選擇題
常溫下,0.2 mol/L的一元酸HCl與等濃度的MOH溶液等體積混合后,所得溶液中部分微粒組成及濃度如圖所示,下列說法正確的是
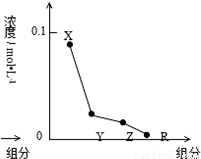
A. MOH的電離方程式:MOH=M++OH-
B.該混合液中水電離出的c(H+)<l0-7mol/L
C.該混合溶液中:c(Y)+c(X)=c(R)+c(Z)
D.圖中c(X)+c(Z)=0.1mol/L
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:實驗題
(14分)在呼吸面具和潛水艇中可用過氧化鈉作為供氧劑。請用如圖實驗裝置,選用適當的化學試劑和實驗用品,設計并完成對過氧化鈉這一性質的探究。
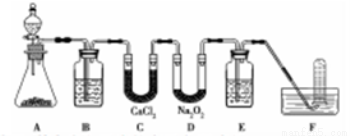
(1)A是實驗室制取CO2的裝置,其中發生反應的離子方程式是________;裝置B的作用是____________。
(2)檢驗F中氣體成分,即能說明過氧化鈉可作潛水艇供氧劑,則實驗操作的方法及現象是_______________。
(3)查閱有關資料表明:2H2O+2Na2O2=4NaOH+O2↑。某研究小組用同位素標記法對過氧化鈉進行標記(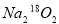 ),以探究這一反應的歷程:_________________
),以探究這一反應的歷程:_________________
①甲同學從電子轉移角度得出其離子方程式為:_______________。
②乙同學發現:向Na2O2與水反應后的溶液中加入MnO2,又產生無色能使帶火星的木條復燃的氣體,從這個角度,寫出其反應歷程:___________________。
(4)設計并完成過氧化鈉樣品(已知所含雜質與酸堿均不反應)的純度測定:
甲、乙兩位同學各取了ag樣品并分別配制成了100.00mL溶液進行實驗,實驗操作中甲同學是將樣品直接溶于蒸餾水中;而乙同學卻是將蒸餾水先加熱煮沸,再把蒸餾水分成兩份,一份中趁熱加入樣品溶解,待冷卻到室溫后再加人另一份水來進行配制。他們分別取出各自配制的溶液20.00mL,加入酚酞數滴后,用濃度為cmol/L的鹽酸進行滴定;重復滴定操作2次,甲同學和乙同學分別計算出了所用鹽酸的體積平均值,分別為VAmL和VWmL。
①在樣品的溶解與配制中,你認為_______(填“甲”、“乙”)同學的操作是合理的,理由是:__________________。
②另一同學的操作將會使實驗結果______(填“偏大”、“偏小”或“無影響”)。
③原過氧化鈉樣品的純度是___________。
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:實驗題
(15分)某探究小組以硫酸和銅為原料設計如下四種制備硫酸銅晶體的路線:

請回答下列有關問題:
(1)甲方案中第一步發生反應的化學方程式為___________________。
(2)甲、乙、丙方案中,_____方案更合理,原因是________________。
(3)采用乙方案,用廢銅、廢酸(含HNO3、H2SO4)為主要原料制備硫酸銅晶體,某含有c(HNO3)=2mol•L-1,c(H2SO4)=4mol•L-1的廢酸混合液100mL(不使用其它酸或氧化劑),最多能制備硫酸銅晶體(CuSO4 •5H2O)的質量為___________。
(4)丙方案中灼燒時,應在________中進行(填儀器名稱),該實驗中的后續操作指的是____________。
(5)丁方案中X可以是試劑,也可以是反應條件:
①若X為試劑,該反應的化學方程式為__________________。
②若X為反應條件,即通電,在虛線框中畫出該實驗設計圖。

查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:填空題
(14分)煤的氣化在煤化工業中占有重要地位,至今仍然是化學工業的重要組成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃燒熱分別為-285.8 kJ/mol、-283.0kJ/mol和-726.5kJ/mol。請寫出甲醇(CH3OH)不完全燃燒生成一氧化碳和液態水的熱化學方程式:____________。
(2)工業上一般在恒容密閉容器中采用下列反應合成甲醇:CO(g)+2H2(g) CH3OH(g) △H。下表所列數據是該反應在不同溫度下的化學平衡常數(K)
CH3OH(g) △H。下表所列數據是該反應在不同溫度下的化學平衡常數(K)
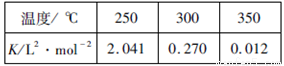
①由表中數據判斷△H_______0(填“>”、“=”或“<”)
②某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應后,4min達到平衡時測得c(CO)=0.2mol/L,此時的溫度為________,則反應速率v(H2)=__________。
(3)T℃時,在t0時刻,合成甲醇反應CO(g)+2H2(g) CH3OH(g)達到平衡,若在t1時刻將容器的體積縮小為原來的½,在t2時刻又達到新的平衡,請在圖中用曲線表示t1~t2時間段氫氣、甲醇物質的量濃度隨時間變化的趨勢示意圖(其他條件不變,曲線上必須標明氫氣、甲醇)。
CH3OH(g)達到平衡,若在t1時刻將容器的體積縮小為原來的½,在t2時刻又達到新的平衡,請在圖中用曲線表示t1~t2時間段氫氣、甲醇物質的量濃度隨時間變化的趨勢示意圖(其他條件不變,曲線上必須標明氫氣、甲醇)。
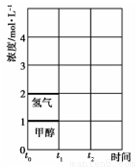
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:實驗題
【化學-選修2:化學與技術】(15分)
實驗室用MnO2、KOH及KClO3原料制取高錳酸鉀的實驗流程如下:
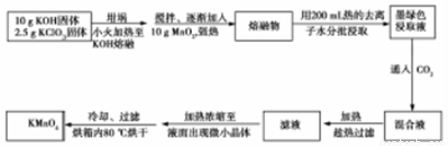
回答下列問題:
(1)實驗中采用_______(填“鐵坩堝”或“瓷坩堝”)加熱KOH和KClO3固體混合物。
(2)熔融時,MnO2轉化為K2MnO4,KClO3轉化為KCl,該反應的化學方程式為__________。
(3)幾種物質的溶解度曲線如圖所示。
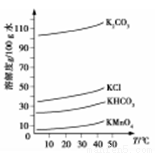
①通入CO2至pH為10~11, K2MnO4轉化為KMnO4和MnO2,該反應的離子方程式為_________。
②不能通入過量CO2的原因是_____________。
(4)趁熱過濾的目的是_________;用冷水洗滌KMnO4晶體較好的原因是_____________。
(5)計算經過上述轉化,最多可制得KMnO4質量為________(結果保留2位小數)。
查看答案和解析>>
科目: 來源:2017屆湖南省長沙市高三入學考試理綜化學試卷(解析版) 題型:填空題
【化學-選修3:物質結構與性質】(15分)
鐵、銅及其化合物在日常生產、生活有著廣泛的應用。請回答下列問題:
(1)鐵在元素周期表中的位置是_________。
(2)配合物Fe(CO)x常溫下呈液態,熔點為-20.5℃,沸點為103℃,易溶于非極性溶劑,據此可判斷Fe(CO)x晶體屬于_______(填晶體類型)。Fe(CO)x的中心原子價電子數與配體提供電子數之和為18,則x=_______;Fe(CO)x在一定條件下發生反應:Fe(CO)x(s) Fe(s)+xCO(g)。已知反應過程中只斷裂配位鍵,由此判斷該反應所形成的化學鍵類型為_________。
Fe(s)+xCO(g)。已知反應過程中只斷裂配位鍵,由此判斷該反應所形成的化學鍵類型為_________。
(3)寫出CO的一種常見等電子體分子的結構式_______;兩者相比較沸點較高的為_____(填化學式)。CN-中碳原子雜化軌道類型為_______,C、N、O三元素的第一電離能最大的為____(用元素符號表示)。
(4)銅晶體中銅原子的堆積方式如圖1所示。
①基態銅原子的核外電子排布式為___________。
②每個銅原子周圍距離最近的銅原子數目________。
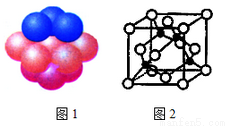
(5)M原子的價電子排布式為3s23p5,銅與M形成化合物的晶胞如圖2所示(黑點代表銅原子)。
①該晶體的化學式為________。
②已知銅和M的電負性分別為1.9和3.0,則銅與M形成的化合物屬于______(填“離子”、“共價”)化合物。
③已知該晶體的密度為ρg·cm-3,阿伏伽德羅常數為NA,則該晶體中銅原子和M原子之間的最短距離為___________pm(只寫計算式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com