
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
四位同學同時進行反應:A(g)+3B(g)=2C(g)+2D(g) 的速率測定實驗,分別測得反應速率如下:
①v(A)= 0.15mol/(L·s)②v(B)= 0.6mol/(L·s) ③v(C)= 0.4mol/(L·s)④v(D)= 0.45mol/(L·s)。
其中反應進行得最快的是
A.① B.② C.③ D.④
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
化學反應中一定伴隨著能量的變化,下列有關能量的說法正確的是
A.等物質的量的硫蒸氣和硫粉分別完全燃燒,后者放出熱量多
B.由C(石墨)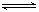 C(金剛石) △H=+1.9kJ/mol可知,金剛石比石墨穩定
C(金剛石) △H=+1.9kJ/mol可知,金剛石比石墨穩定
C.根據熱化學方程式:S(s) + O2(g)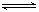 SO2(g) △H=—297.23kJ/mol,可推知1 mol SO2 (g)的能量總和大于1 mo S(s)和1 mol O2(g)的能量總和
SO2(g) △H=—297.23kJ/mol,可推知1 mol SO2 (g)的能量總和大于1 mo S(s)和1 mol O2(g)的能量總和
D.根據稀溶液中反應: H+(aq)+OH—-(aq)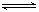 H2O(l) △H=—57.3kJ/mol;若將含0.5 mol H2SO4的濃硫酸與含l mol NaOH的稀溶液混合時,放出的熱量大于57.3 kJ
H2O(l) △H=—57.3kJ/mol;若將含0.5 mol H2SO4的濃硫酸與含l mol NaOH的稀溶液混合時,放出的熱量大于57.3 kJ
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
在一密閉容器中充入NO2,在一定條件下進行反應:2NO2 2NO+O2。達到平衡狀態的標志是
2NO+O2。達到平衡狀態的標志是
A.NO2的消耗速率與NO的生成速率相等
B.容器內NO2的物質的量與NO的物質的量相等
C.NO2和O2的消耗速率之比為2∶1
D.單位時間內生成2n mol NO。同時生成n mol O2
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
下列說法中正確的是
A.化學平衡常數越大,說明該反應進行得越完全
B.可逆反應達到化學平衡狀態后,改變外界條件不會改變平衡狀態
C.化學反應中,物質含有的活化分子數目越多,化學反應速率越快
D.可逆反應維持的時間越長,生成物的百分含量必定越高
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
可逆反應N2(g)+3H2(g) 2NH3(g),500 ℃時在容積為10 L的密閉容器中進行,開始時加入1 mol N2和6 mol H2,則達到平衡時,NH3的濃度不可能達到
2NH3(g),500 ℃時在容積為10 L的密閉容器中進行,開始時加入1 mol N2和6 mol H2,則達到平衡時,NH3的濃度不可能達到
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.05 mol·L-1 D.0.15 mol·L-1
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
下列各組熱化學方程式中,△H1>△H2的是
①C(s)+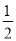 O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+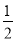 O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+CO2(g)=== CaCO3(s) △H2
A.①③④ B.②③④ C.①②③④ D.①②③
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
化學平衡常數K的數值大小是衡量化學反應進行程度的標志,在常溫下,下列反應的平衡常數的數值如下:
2NO(g)  N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)  2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)  2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下說法正確的是
A.常溫下,NO分解產生O2的反應的平衡常數表達式為K1=c(N2)·c(O2)
B.常溫下,水分解產生O2,此時平衡常數的數值約為5×10-80
C.常溫下,NO、H2O、CO2三種物質分解放出O2的傾向由大到小的順序為NO>H2O>CO2
D.以上說法都不正確
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
下圖是某空間站能量轉化系統的局部示意圖,其中燃料電池采用KOH為電解液,下列有關說法中不正確的是

A.該能量轉化系統中的水也是可以循環的
B.燃料電池系統產生的能量實際上來自于水
C.水電解系統中的陽極反應:4OH-―4e-=2H2O+O2↑
D.燃料電池放電時的負極反應:H2-2e-+2OH-=2H2O
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
在理論上可用于設計原電池的化學反應是
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B.Ba(OH)2·8H2O(s)+2NH4C l(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H
l(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H  >0
>0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D.FeCl3(aq)十3H2O(1)  Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目: 來源:2015-2016學年江蘇省高二下期中化學試卷(解析版) 題型:選擇題
下列說法中正確的是
A.決定化學反應速率的主要因素是反應物的濃度、壓強、溫度、催化劑等
B.測定HCl和NaOH反應的中和熱時,每次實驗均應測量3個溫度,即鹽酸的起始溫度.NaOH溶液的起始溫度和反應后反應體系的最高溫度
C.稀醋酸與稀NaOH溶液反應生成1mol水,放出57.3kJ熱量
D.某可逆反應的化學平衡常數K,只隨溫度的改變而改變,且溫度越高K值一定越大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com