
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:選擇題
哈伯因發明了由氮氣和氫氣合成氨氣的方法而獲得1918年諾貝爾化學獎.現向一密閉容器中充入1mol N2和3mol H2,在一定條件下使該反應發生.下列有關說法正確的是( )
A.達到化學平衡時,N2將完全轉化為NH3
B.達到化學平衡時,N2、H2和NH3的物質的量濃度一定相等
C.達到化學平衡時,正反應和逆反應的速率都為零
D.達到化學平衡時,N2、H2和NH3的物質的量濃度不再變化
查看答案和解析>>
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:選擇題
對于反應A2+3B2===2C來說,以下化學反應速率的表示中,反應速率最快的是( )
A.v(B2)=0.8 mol/(L·s) B.v(A2)=0.5 mol/(L·s)
C.v(C)=0.6 mol/(L·s) D.v(B2)=1.2 mol/(L·s)
查看答案和解析>>
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:填空題
有下列四種微粒:①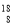 O、②
O、②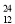 Mg、③2311Na、④
Mg、③2311Na、④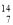 N,
N,
(1)按原子半徑由大到小順序排列的是_____________________(用序號填空)
(2)微粒中質子數小于中子數的是______________________________(用序號填空)
(3)在化合物中呈現的化合價的數值最多的是____________________(用序號填空)
(4)能形成X3Y2型化合物的是___________(用序號填空);
寫出形成X2Y2型化合物的電子式_________________。
查看答案和解析>>
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:填空題
下列反應:
①氫氧化鈉與硫酸,②一氧化碳與氧氣,③八水合氫氧化鋇與氯化銨,④金屬銅與硝酸銀。
(1)屬于復分解反應的放熱反應的是____________________________。(用序號填空)
(2)屬于吸熱反應的是_____________________________________________。(用序號填空)
(3)能設計成原電池的反應是_______________________________________。(用序號填空)
(4)能設計成燃料電池的反應是_____________________________________。(用序號填空)
(5) 寫出③發生反應的化學方程式___________________________________。
寫出④發生反應的離子方程式___________________________________。
查看答案和解析>>
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:填空題
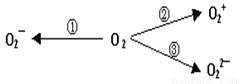
意大利科學家使用普通氧分子和帶正電的氧離子作用,制出了新型的氧分子O4,它的結構很復雜,可能具有與S4相似的長方形結構,是一種高能量分子。
(1)下列有關O4的說法正確的是:
A.O4分子內存在極性共價鍵
B.合成O4的反應可看作核聚變反應,不屬于化學變化
C.O4與O3、O2都是氧的同素異形體
D.O4將來可用作更強有力的火箭推進的氧化劑
(2)制備含O2-、O22-甚至O2+的化合物都是可能的,通常它們是在氧分子進行下列各種反應時生成的:上述變化中, (填序號)相當于氧分子被氧化; _______(填序號)相當于氧分子被還原。
(3)寫出O22—的電子式: (4) O2+、O2-中的電子數分別為: ; __。
查看答案和解析>>
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:填空題
元素在周期表中的位置反映了元素的原子結構和元素的性質。下是元素周期表的一部分。
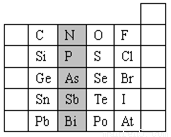
(1)陰影部分元素N在元素周期表中的位置為 。
根據元素周期律,請你預測:H3AsO4、H3PO4 的酸性強弱:H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正價和最低負價分別為 、 ,在一定條件下,S與H2反應有一定限度(可理解為反應進行的程度),請判斷在相同條件下Se與H2反應的限度(選填“更大”、“更小”或“相同”) 。
查看答案和解析>>
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:填空題
某同學為驗證元素周期表中元素性質的遞變規律,利用右圖裝置可驗證同主族非金屬性的變化規律。設計了如下系列實驗。
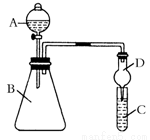
(1)向Na2S溶液中通入氯氣出現淡黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為____________________________________________。
(2)儀器A的名稱為____________________,
(3)若要證明非金屬性:Cl>I,則A中加濃鹽酸,B中加KMnO4, (KMnO4 與濃鹽酸常溫下反應生成氯氣),C中加淀粉碘化鉀混合溶液,觀察到混合溶液 的現象,即可證明。從環境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用______________ 溶液吸收尾氣。
(4)若要證明非金屬性:C>Si,則在A中加鹽酸、B中加CaCO3,C中加Na2SiO3 溶液觀察到C中溶液_____________的現象,即可證明。但有的同學認為鹽酸具有揮發性,應用__________溶液除去。
查看答案和解析>>
科目: 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:填空題
由Zn—Cu—硫酸溶液組成的原電池,工作一段時間后,鋅片的質量減少了6.5 g。回答下列問題:
(1)上述原電池的正極是:___________,負極的電極反應式:__________________________________。
(2)若將電解質溶液改為硫酸銅溶液,負極是:________,正極的電極反應式:_________________。當電池輸出相同的電量時,電池兩極的質量差為______________。
查看答案和解析>>
科目: 來源:2015-2016學年湖北省襄陽市高一5月月考化學試卷(解析版) 題型:選擇題
W、X、Y、Z是短周期元素,其部分性質如下表:

下列說法不正確的是( )
A.第一電離能:Y>Z
B.離子半徑:W>Z
C.X、Y形成的化合物XY4是離子化合物
D.工業上利用電解熔融Z的氧化物生產Z金屬單質
查看答案和解析>>
科目: 來源:2015-2016學年湖北省襄陽市高一5月月考化學試卷(解析版) 題型:選擇題
下列實驗事實:
①常溫下S為固體,而Cl2為氣體;
②Cl2與H2混合,強光照射劇烈反應,而S與H2反應需較高溫度;
③Cl2與Fe反應,Cl2生成FeCl3,而S與Fe生成FeS;
④鹽酸是強酸,而氫硫酸是弱酸;
⑤將Cl2通入氫硫酸中可置換出S
能說明Cl的非金屬性比S強的事實有()
A.①③⑤ B.②③④ C.②③⑤ D.②③④⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com