
科目: 來源:2016屆吉林省高三上四次模擬化學卷(解析版) 題型:選擇題
在1L溶液中含有Fe(NO3)3和H2SO4兩種溶質,其濃度分別為0.2 mol•L-1和1.5 mol•L-1,現向該溶液中加入39.2g鐵粉使其充分反應,下列有關說法正確的是
A.反應后溶液中Fe3+物質的量為0.8 mol
B.反應后產生13.44 L H2(標準狀況)
C.反應后溶液中Fe2+和Fe3+物質的量之和為0.9 mol
D.由于氧化性Fe3+>H+,故反應中先沒有氣體產生后產生氣體
查看答案和解析>>
科目: 來源:2016屆吉林省高三上四次模擬化學卷(解析版) 題型:填空題
Ⅰ.圖1是某壓強下工業合成氨生產過程中,N2與H2按體積比為1:3投料時,反應混合物中氨的體積分數隨溫度的變化曲線,其中一條是經過一定時間反應后的曲線,另一條是平衡時的曲線。
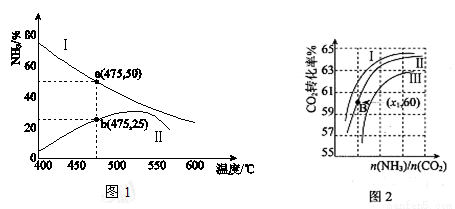
(1)圖中表示該反應的平衡曲線的是__________(填“Ⅰ”或“Ⅱ”);由圖中曲線變化趨勢可推知工業合成氨的反應是___________(填“吸熱”或“放熱”)反應。
(2)圖中a點,容器內氣體n(N2):n(NH3)= ____________,圖中b點,v(正)_________v(逆)(填“>”、“=”或“<”)。
Ⅱ.以工業合成氨為原料,進一步合成尿素的反應原理為:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
工業生產時,需要原料氣帶有水蒸汽,圖2中曲線I、Ⅱ、Ⅲ表示在不同水碳比[n(H2O)/n(CO2)]時,CO2的轉化率與氨碳比[n(NH3)/n(CO2)]之間的關系。
(1)寫出該反應的化學平衡常數表達式____________________
(2)曲線Ⅰ、Ⅱ、Ⅲ對應的水碳比最大的是_________,判斷依據是_______________
(3)測得B點氨的轉化率為40%,則x1=__________。
查看答案和解析>>
科目: 來源:2016屆黑龍江省高三上期末理綜化學試卷(解析版) 題型:選擇題
生活中碰到的某些問題和物質,常涉及到化學知識,下列分析不正確的是
A.維生素A:  它是一種難溶于水的醇
它是一種難溶于水的醇
B.用灼燒并聞氣味的方法區別純棉織物和純毛織物
C.某雨水樣品采集后放置一段時間,pH值由4.68變為4.28,是因為水中溶解了較多的CO2
D.金屬材料都是導體,非金屬材料不都是絕緣體
查看答案和解析>>
科目: 來源:2016屆黑龍江省高三上期末理綜化學試卷(解析版) 題型:選擇題
A-D是含同一元素的四種物質,相互之間有如圖的轉化關系,其中A是單質,D是最高價氧化物的水合物。那么A不可能是
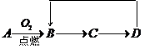
A.S B.Si C.Al D.Fe
查看答案和解析>>
科目: 來源:2016屆黑龍江省高三上期末理綜化學試卷(解析版) 題型:填空題
氰(CN)2的化學性質與鹵素很相似(X2),稱為擬鹵素,氰能和氫氣反應生成HCN,其水溶液是一種酸。氰的氧化性比溴弱、比碘強。
(1)HCN分子中含有4個共價鍵,寫出HCN的結構式:____________。
(2)KCN溶液顯堿性,原因是____________(用離子方程式表示)。
(3)下列有關方程式不正確的是____________。
A.(CN)2+2NaOH===NaCN+NaCNO+H2O
B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O
C.I2+2KCN===2KI+(CN)2
D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等體積混合,若溶液最終PH=8,則c(CN-) c(HCN),原因是 。此溶液中c(CN-)與c(HCN)差值的數值為:
(5)已知HCN可以在氧氣中燃燒成CO2、H2O和N2,由此原理可以設計酸性條件下原電池,書寫其負極反應式: 。
查看答案和解析>>
科目: 來源:2016屆黑龍江省高三上期末理綜化學試卷(解析版) 題型:推斷題
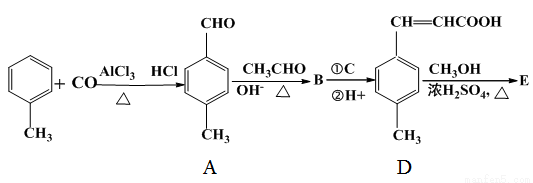
3-對甲苯丙烯酸甲酯(E)是一種用于合成抗血栓藥的中間體,其合成路線如下:
已知:HCHO+CH3CHO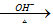 CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液顯紫色且苯環上有兩個取代基的A的同分異構體有________種。D的含苯環且苯環上三元取代物,顯酸性的同分異構體有 種。B中含氧官能團的名稱為_____________。
(2)試劑C可選用下列中的________。
a.溴水
b.銀氨溶液
c.酸性KMnO4溶液
d.新制Cu(OH)2懸濁液
(3)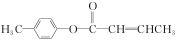 是E的一種同分異構體,該物質與足量NaOH溶液共熱的化學方程式為___________________________。
是E的一種同分異構體,該物質與足量NaOH溶液共熱的化學方程式為___________________________。
(4)E在一定條件下可以生成高聚物F,F的結構簡式為____________________。
(5)A、D、E中可以通過化學反應而使溴水褪色的是 。
查看答案和解析>>
科目: 來源:2016屆安徽省高三上第四次月考化學試卷(解析版) 題型:選擇題
下列對一些實驗事實的理論解釋正確的是
選項 | 實 驗 事 實 | 理 論 解 釋 |
A. | SO2溶于水形成的溶液能導電 | SO2是電解質 |
B. | 白磷為正四面體分子 | 白磷分子中P-P間的鍵角是109°28′ |
C. | 1體積水可以溶解700體積氨氣 | 氨是極性分子且由于有氫鍵的影響 |
D. | HF的沸點高于HCl | H-F的鍵長比H-Cl的鍵長短 |
查看答案和解析>>
科目: 來源:2016屆安徽省高三上第四次月考化學試卷(解析版) 題型:選擇題
氯化硼的熔點為-107℃、沸點為12.5℃,在氯化硼分子中,氯—硼—氯鍵角為120º,它可以水解,水解產物之一是氯化氫,下列對氯化硼的敘述中正確的是
A.氯化硼是原子晶體
B.熔化時,氯化硼能導電
C.硼原子以sp3雜化
D.水解方程式:BCl3+3H2O H3BO3+3HCl
H3BO3+3HCl
查看答案和解析>>
科目: 來源:2016屆安徽省高三上第四次月考化學試卷(解析版) 題型:填空題
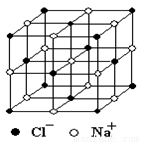
晶體具有規則的幾何外形,晶體中最基本的重復單元稱之為晶胞。NaCl的晶胞如圖所示,隨著科學技術的發展,測定阿伏加德羅常數的手段越來越多,測定精確度也越來越高。現有一簡單可行的測定方法,具體步驟如下:①將NaCl固體研細、干燥后,準確稱取m g NaCl固體并轉移到定容儀器A中。②用滴定管向A儀器中加苯,不斷振蕩,繼續加苯到A儀器的刻度線,計算出NaCl固體的體積為V mL。回答下列問題:
(1)步驟①中儀器A最好用________________(填儀器名稱)。
(2)你認為步驟②中是用_________(填“酸式”或“堿式”)滴定管,原因是________________。
(3)能否用膠頭滴管代替步驟②中的滴定管__________,其原因是________________。
(4)經X-射線衍射測得NaCl晶體中相鄰Na+和Cl-的核間距為acm.則利用上述方法測得的阿伏加德羅常數的數學表達式為NA=________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com