
科目: 來源: 題型:
| ||
| ||
| 1000°C |
| ═ |
| ||
查看答案和解析>>
科目: 來源: 題型:
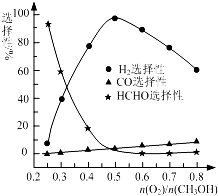 甲醇來源豐富、價格低廉、運輸貯存方便,有著重要的用途和應用前景.
甲醇來源豐富、價格低廉、運輸貯存方便,有著重要的用途和應用前景.| 1 |
| 2 |
| 1 |
| 2 |
| n(O2) |
| n(CH3OH) |
| ||
查看答案和解析>>
科目: 來源: 題型:
| A、x=1 |
| B、2min內A的反應速率為0.3mol?L-1?min-1 |
| C、B的轉化率為50% |
| D、若混合氣體的平均相對分子質量不變,則表明該反應達到平衡狀態(tài) |
查看答案和解析>>
科目: 來源: 題型:

| A、向溴化銀的濁液中加入溴化鈉溶液,溴化銀的Ksp減小 |
| B、向c點的溶液中加入0.1mol?L-1AgNO3,則c(Br-)減小 |
| C、升高溫度可以實現(xiàn)c點到b點的轉化 |
| D、圖中b點對應的是不飽和溶液 |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
| 元素 | 有關信息 |
| A | 最高價氧化物對應的水化物與其氫化物反應生成離子化合物 |
| B | 地殼中含量最多的元素 |
| C | 單質須保存在煤油中 |
| D | 原子最外層電子數(shù)比次外層電子數(shù)少1個 |
| E | 單質既可與鹽酸反應,又可與NaOH溶液反應 |
查看答案和解析>>
科目: 來源: 題型:
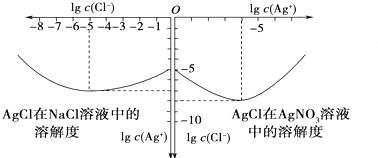
| c(Br-) |
| c(Cl-) |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com