
科目: 來源: 題型:
| 實驗 序號 | 碳酸鈣 狀態(tài) | C(HCl)/ mol?L-1 | 溶液溫度/℃ | 碳酸鈣消失 時間/s | |
| 反應前 | 反應后 | ||||
| 1 | 塊狀 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 塊狀 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 塊狀 | 1.0 | 20 | 40 | 120 |
| 6 | 塊狀 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目: 來源: 題型:

| 操作 | 現(xiàn)象 | 結(jié)論 |
| 假設一不成立 |
查看答案和解析>>
科目: 來源: 題型:
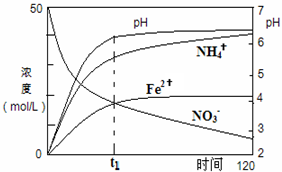 氮元素的化合物在工農(nóng)業(yè)以及國防科技中用途廣泛,但也會對環(huán)境造成污染,如地下水中硝酸鹽造成的氮污染已成為一個世界性的環(huán)境問題.
氮元素的化合物在工農(nóng)業(yè)以及國防科技中用途廣泛,但也會對環(huán)境造成污染,如地下水中硝酸鹽造成的氮污染已成為一個世界性的環(huán)境問題.查看答案和解析>>
科目: 來源: 題型:
| 實驗序號 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |
| ② | 20mL 0.2mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |

查看答案和解析>>
科目: 來源: 題型:
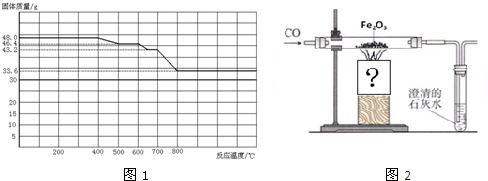
查看答案和解析>>
科目: 來源: 題型:
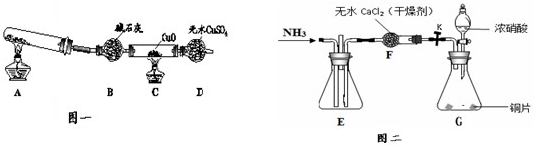
查看答案和解析>>
科目: 來源: 題型:
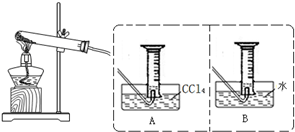 為探究Fe(NO3)2等硝酸鹽熱分解產(chǎn)物和產(chǎn)物的性質(zhì),某化學小組開展如下探究性學習:查閱資料:金屬活潑性不同,其硝酸鹽分解產(chǎn)物不同.
為探究Fe(NO3)2等硝酸鹽熱分解產(chǎn)物和產(chǎn)物的性質(zhì),某化學小組開展如下探究性學習:查閱資料:金屬活潑性不同,其硝酸鹽分解產(chǎn)物不同.
| ||
| ||
| ||
查看答案和解析>>
科目: 來源: 題型:
| A、Cu與稀鹽酸 |
| B、NaHCO3與NaOH溶液 |
| C、CaCO3與稀硫酸 |
| D、NH4HCO3與稀鹽酸 |
查看答案和解析>>
科目: 來源: 題型:
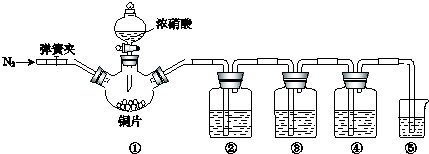
| 實驗過程 | 實驗現(xiàn)象 |
| Ⅰ.檢驗裝置的氣密性 | \ |
| Ⅱ.… | \ |
| Ⅲ.打開分液漏斗活塞,將濃硝酸緩慢滴入燒瓶中,關閉活塞. | ①中產(chǎn)生大量的紅棕色氣體,紅棕色氣體在②中變?yōu)闊o色,氣體通過③后依然為無色,通過④后變?yōu)榧t棕色 |
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com