
科目: 來源:2014年高中化學二輪創新訓練上 專題5化學反應與能量變化練習卷(解析版) 題型:選擇題
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
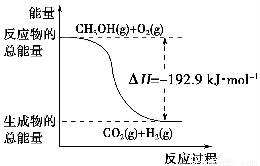
②CH3OH(g)+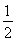 O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
下列說法正確的是 ( )。
A.CH3OH轉變成H2的過程一定要吸收能量
B.①反應中,反應物的總能量高于生成物總能量
C.根據②推知反應:CH3OH(l)+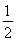 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反應②中的能量變化如下圖所示
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題5化學反應與能量變化練習卷(解析版) 題型:選擇題
工業生產硫酸過程中,SO2在接觸室中被催化氧化為SO3,已知該反應為放熱反應。現將2 mol SO2、1 mol O2充入一密閉容器充分反應后,放出熱量98.3 kJ,此時測得SO2的轉化率為50%。下列熱化學方程式正確的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1
SO3(g)ΔH=-98.3 kJ·mol-1
C.SO2(g)+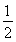 O2(g)
O2(g)  SO3(g)ΔH=+98.3 kJ·mol-1
SO3(g)ΔH=+98.3 kJ·mol-1
D.SO2(g)+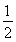 O2(g)
O2(g)  SO3(g)ΔH=-196.6 kJ·mol-1
SO3(g)ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題5化學反應與能量變化練習卷(解析版) 題型:選擇題
已知:①1 mol H2分子中化學鍵斷裂時需要吸收436 kJ的能量 ②1 mol Cl2分子中化學鍵斷裂時需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子時釋放431 kJ的能量。下列敘述正確的是 ( )。
A.氫氣和氯氣反應生成氯化氫氣體的熱化學方程式是H2(g)+Cl2(g)=2HCl(g)
B.氫氣和氯氣反應生成2 mol氯化氫氣體,反應的ΔH=+183 kJ·mol-1
C.氫氣和氯氣反應生成2 mol氯化氫氣體,反應的ΔH=-183 kJ·mol-1
D.氫氣和氯氣反應生成1 mol氯化氫氣體,反應的ΔH=+183 kJ·mol-1
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題5化學反應與能量變化練習卷(解析版) 題型:選擇題
有關熱化學方程式書寫與對應表述均正確的是 ( )。
A.稀醋酸與0.1 mol·L-1 NaOH溶液反應:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
B.密閉容器中,9.6 g硫粉與11.2 g鐵粉混合加熱生成硫化亞鐵17.6 g時,放出19.12 kJ熱量,則Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1
C.氫氣的燃燒熱為285.5 kJ·mol-1,則水電解的熱化學方程式為2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D.已知2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,則可知C的燃燒熱為110.5 kJ·mol-1
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題5化學反應與能量變化練習卷(解析版) 題型:填空題
(1)由磷灰石[主要成分Ca5(PO4)3F]在高溫下制備黃磷(P4)的熱化學方程式為:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反應中,副產物礦渣可用來________。
②已知相同條件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江蘇)用H2O2和H2SO4的混合溶液可溶出印刷電路板金屬粉末中的銅。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+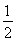 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu與H2O2反應生成Cu2+和H2O的熱化學方程式為_________________________________________________________________。
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題5化學反應與能量變化練習卷(解析版) 題型:填空題
白磷、紅磷是磷的兩種同素異形體,在空氣中燃燒得到磷的氧化物,空氣不足時生成P4O6,空氣充足時生成P4O10。
(1)已知298 K時白磷、紅磷完全燃燒的熱化學方程式分別為P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2 983.2 kJ·mol-1;P(s,紅磷)+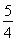 O2(g)=
O2(g)=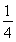 P4O10(s)ΔH2=-738.5 kJ·mol-1,則該溫度下白磷轉化為紅磷的熱化學方程式為________________。
P4O10(s)ΔH2=-738.5 kJ·mol-1,則該溫度下白磷轉化為紅磷的熱化學方程式為________________。
(2)已知298 K時白磷不完全燃燒的熱化學方程式為P4(s,白磷)+3O2(g)=P4O6(s)ΔH=-1 638 kJ·mol-1。在某密閉容器中加入62 g白磷和50.4 L氧氣(標準狀況),控制條件使之恰好完全反應。則所得到的P4O10與P4O6的物質的量之比為________,反應過程中放出的熱量為________。
(3)已知白磷和PCl3的分子結構如圖所示,現提供以下化學鍵的鍵能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

則反應P4(s,白磷)+6Cl2(g)=4PCl3(s)的反應熱ΔH=________。
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題5化學反應與能量變化練習卷(解析版) 題型:填空題
甲醇是一種可再生能源,具有廣泛的開發和應用前景。
(1)工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H2(g)=CH3OH(g) ΔH1
反應Ⅱ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
①上述反應符合“原子經濟”原則的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列數據是反應Ⅰ在不同溫度下的化學平衡常數(K)。
溫度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中數據判斷,ΔH1______0(填“>”、“=”或“<”)。
③某溫度下,將2 mol CO和6 mol H2充入2 L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2 mol·L-1,則CO的轉化率為________,此時的溫度為________(從上表中選擇)。
(2)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:__________________________。
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
化學平衡常數可以用K來表示,下列關于化學平衡常數的說法中正確的是( )。
A.K越大,反應物的轉化率越小
B.K與反應物的濃度有關
C.K與生成物的濃度有關
D.K與溫度有關
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
已知反應4NH3+5O2 4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列正確的關系是 ( )。
4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列正確的關系是 ( )。
A.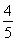 v(NH3)=v(O2)
v(NH3)=v(O2)
B.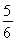 v(O2)=v(H2O)
v(O2)=v(H2O)
C.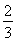 v(NH3)=v(H2O)
v(NH3)=v(H2O)
D.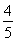 v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目: 來源:2014年高中化學二輪創新訓練上 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
下列條件一定能使反應速率加快的是 ( )。
①增加反應物的物質的量 ②升高溫度 ③增大反應體系的壓強 ④不斷分離出生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com