
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:選擇題
鐵氧體(Fe3O4)法是處理含鉻廢水的常用方法,其原理是用FeSO4把廢水中的Cr2O72-還原為Cr3+,并通過調節廢水的pH,使生成物組成符合類似于鐵氧體(Fe3O4或FeO·Fe2O3)的復合氧化物(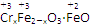 )。處理含1 mol Cr2O72-的廢水至少需要加入a mol FeSO4·7H2O,下列結論正確的是( )
)。處理含1 mol Cr2O72-的廢水至少需要加入a mol FeSO4·7H2O,下列結論正確的是( )
A.x=1,a=5 B.x=0.5,a=8
C.x=1,a=10 D.x=0.5,a=10
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:選擇題
a mol FeS與b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反應,產生NO氣體,
所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,則反應中未被還原的硝酸可能為( )
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④(cV-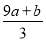 ) mol
) mol
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:填空題
現有A、B、C、D、E、F六種常見化合物,已知它們包含的陽離子有K+、Ag+、Na+、
Ba2+、Fe2+、Al3+,陰離子有Cl-、OH-、AlO2-、NO3-、SO42-、CO32-。將它們分別配成0.1 mol/L的溶液進行如下實驗:
①測得溶液A、C、E均呈堿性,且堿性A>E>C,E的焰色呈淺紫色(透過藍色鈷玻璃觀察);②向B溶液中滴加稀氨水至過量,先生成沉淀,后沉淀全部溶解;③向F溶液中滴加稀硝酸,溶液變成棕黃色,且有無色氣體生成;④向D溶液中滴加Ba(NO3)2溶液無明顯現象。
(1)寫出A、D、E、F的化學式:
A________;D________;E________;F________。
(2)用離子方程式解釋C溶液呈堿性的原因:__________________________________。
(3)寫出實驗③中反應的離子方程式:________________________________。
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:填空題
現代循環經濟要求綜合考慮環境污染和經濟效益。高純氧化鐵可作現代電子工業的材料,
以下是以硫鐵礦燒渣(主要成分為Fe2O3、Fe3O4、FeO、SiO2)為原料制備高純氧化鐵(軟磁α?Fe2O3)的生產流程示意圖:
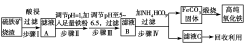
(1)步驟Ⅰ中過濾所得濾渣的主要成分是________。
(2)步驟Ⅱ中加入鐵粉的目的是________。
(3)步驟Ⅲ中可選用________調節溶液的pH。
A.稀硝酸 B.雙氧水 C.氨水 D.高錳酸鉀溶液
(4)寫出在空氣中煅燒FeCO3,制備高純氧化鐵的化學方程式:_______________________。
(5)從濾液C中回收的主要物質的一種用途是_________________________________。
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:填空題
某工廠對制革工業污泥中Cr(Ⅲ)回收與再利用工藝如下(硫酸浸取液中金屬離子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。
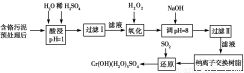
氫氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 11.1 | 8 | 9(>9溶液) |
部分陽離子常溫下以氫氧化物形式完全沉淀時溶液的pH見上表。
(1)酸浸時,為了提高浸取率可采取的措施為________________(至少寫一條)。
(2)調pH=8是為了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)鈉離子交換樹脂的原理為Mn++nNaR―→MRn+nNa+,被交換的雜質離子是________。
(4)試配平反應方程式:
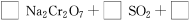
 ;
;
生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物質的量為________。
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:填空題
已知A、B、C、D、E、F、G、H可以發生如圖所示的轉化,反應中部分生成物已略去。其中,A、G為同一主族元素的單質,B、C、H在通常情況下為氣體,化合物C是一種形成酸雨的大氣污染物。
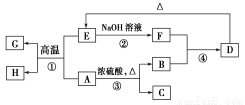
請完成以下填空:
(1)H的名稱是________。
(2)E的兩種用途是________、________。
(3)反應③的化學方程式是________。
(4)反應④的離子方程式是________。
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:填空題
X、Y、Z、Q、W、R六種短周期元素原子序數依次增大。化合物甲由X、Z、Q三種元素組成,常溫下0.1 mol/L甲溶液的pH=13。工業上常用電解飽和QR溶液生成甲;化合物乙由X、R兩種元素組成。請回答下列問題:
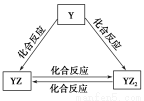
(1)Q的原子結構示意圖為________。
(2)Y元素的單質能發生如圖所示的轉化,則Y元素為________(填元素符號)。
在甲溶液中通入足量YZ2氣體,所得溶液呈堿性,原因是__________________(用離子方程式和必要的文字說明)。
(3)W的單質既能與甲溶液反應,又能與乙溶液反應。
①常溫下,將W的單質和甲溶液混合,發生反應的離子方程式為______________________________________________________________________________;
②Q、W兩種元素金屬性的強弱為Q________W(填“<”或“>”),下列表述中能證明這一事實的是________(填序號)。
a.Q單質的熔點比W單質的低
b.Q的最高價氧化物的水化物的堿性比W的最高價氧化物的水化物的堿性強
c.W的原子序數大
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:選擇題
短周期元素A、B、C的原子序數依次增大,其原子的最外層電子數之和為10,則A與
C在周期表中位置上下相鄰,B原子最外層電子數等于A原子次外層電子數,下列有關敘述不正確的是( )
A.A與C可形成共價化合物
B.A的氫化物的穩定性大于C的氫化物的穩定性
C.原子半徑A<B<C
D.B的氧化物的熔點比A的氧化物熔點低
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:填空題
已知A、B、C、D四種短周期元素原子序數依次增大,A與D的原子序數之和等于B
與C的原子序數之和,由D元素組成的單質在通常狀況下呈黃綠色,B、C、D三種元素位于同一周期,B、C、D三種元素的最高價氧化物對應的水化物分別為X、Y、Z,且X、Y、Z可兩兩相互反應生成鹽和水,請用相應的化學用語回答下列問題:
(1)D元素原子的結構示意圖為________;
(2)X與C元素的最高價氧化物可以發生反應,該反應的離子方程式為________;
(3)A、B、C三種元素的原子半徑由小到大的順序為________;
(4)A與D兩元素的氣態氫化物之間可以反應生成一種鹽,該鹽的水溶液呈________(填“酸”、“堿”或“中”)性,該溶液中各離子濃度由小到大的順序為________。
查看答案和解析>>
科目: 來源:2014年高考化學一輪復習課后訓練專題練習卷一(解析版) 題型:填空題
現有A、B、C、D、E、F六種短周期元素,原子序數依次增大。已知A與D、C與E
分別同主族,D、E、F同周期。A、B的最外層電子數之和與C的最外層電子數相等,A分別與B、C可形成電子總數相等的分子,且A與C、A與E、A與F也可以形成電子總數相等的分子。
請回答下列問題:
(1)元素F在周期表中的位置________________________________________________。
(2)A、C、D三種元素可組成一種常見化合物,該化合物的化學式為________;工業生產該化合物和單質F的離子方程式為_________________________________________。
(3)B與F形成的化合物分子中,各原子最外層均達8電子結構,則該分子的電子式為________________________________________________________________________。
(4)已知0.50 mol EC2被C2氧化成氣態EC3,放出49.15 kJ熱量,其熱化學方程式為_________________________________________________________________________。
(5)A、B、C以原子個數比4∶2∶3所形成的化合物,所含的化學鍵類型為____________。
0.1 mol·L-1該化合物水溶液中的離子濃度由大到小的順序為_________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com