
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:選擇題
下列氧化還原反應中,實際參加反應的氧化劑與還原劑的物質的量之比正確的是( )
①KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O;1:6
②Fe2O3+2Al Al2O3+2Fe;1:2
Al2O3+2Fe;1:2
③SiO2+3C=SiC+2CO↑;1:2
④3NO2+H2O=2HNO3+NO;2:1
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:選擇題
古代曾用綠礬加強熱得到硫酸、紅色粉末和有刺激性氣味的氣體,此反應屬于( )
A.有氧化還原的分解反應
B.無氧化還原的分解反應
C.只是氧化還原反應
D.只是分解反應
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:選擇題
被稱為萬能還原劑的NaBH4溶于水并和水反應:NaBH4+2H2O=NaBO2+4H2↑,下列說法中正確的是(NaBH4中H為-1價)( )
A.NaBH4既是氧化劑又是還原劑
B.NaBH4是氧化劑,H2O是還原劑
C.硼元素被氧化,氫元素被還原
D.被氧化的元素與被還原的元素質量之比為1:1
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:選擇題
Na2FeO4是一種高效多功能水處理劑。一種制備Na2FeO4的方法可用化學方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列說法中不正確的是( )
A.Na2O2在上述反應中只作氧化劑
B.Na2FeO4既是氧化產物又是還原產物
C.Na2FeO4處理水時,既能殺菌,又能在處理水時產生膠體凈水
D.2 mol FeSO4發(fā)生反應時,共有10 mol電子發(fā)生轉移
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:選擇題
將SO2氣體與足量Fe2(SO4)3溶液完全反應后,再加入K2Cr2O7溶液,發(fā)生如下兩個化學反應:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有關說法不正確的是( )
A.氧化性Cr2O72->Fe3+>SO2
B.Cr2O72-能將Na2SO3氧化成Na2SO4
C.若33.6 L SO2(標準狀況)參加反應,則最終消耗K2Cr2O7 0.5 mol
D.反應中Fe2(SO4)3既是氧化劑,又是還原劑
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:選擇題
若(NH4)2SO4在強熱時分解的產物是SO2、N2、NH3和H2O,則該反應中化合價發(fā)生變化和未發(fā)生變化的N原子數(shù)之比為( )
A.1:4 B.1:2 C.2:1 D.4:1
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:選擇題
氯酸是一種強酸,濃度超過40%時會發(fā)生分解,反應可表示為:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,下列說法正確的是( )
A.由反應可知,氧氣、氯氣均為氧化產物
B.若化學計量數(shù)a=8,則該反應轉移電子數(shù)為12e-
C.若b確定,則方程式中其他物質的化學計量數(shù)均能確定
D.若氯酸分解所得混合氣體,1 mol混合氣體質量為51.5 g,則反應方程式可表示為:5HClO3=O2↑+Cl2↑+3HClO4+H2O
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:填空題
某反應中反應物與生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一種未知物質X。
(1)已知KBrO3在反應中得到電子,則該反應的還原劑是 。
(2)已知0.2 mol KBrO3在反應中得到1 mol電子生成X,則X的化學式為 。
(3)根據(jù)上述反應可推知
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.還原性:AsH3>X
d.還原性:X>AsH3
(4)將氧化劑和還原劑的化學式及其配平后的計量數(shù)填入下列方框中,并標出電子轉移的方向和數(shù)目。
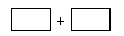
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:填空題
某反應體系的物質有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)請將Au2O3之外的反應物與生成物分別填入以下空格內。
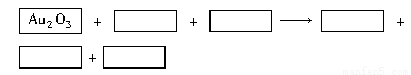
(2)反應中,被還原的元素是 ,還原劑是 。
(3)將氧化劑與還原劑填入空格中,并標出電子轉移的方向和數(shù)目。

(4)紡織工業(yè)中常用氯氣作漂白劑,Na2S2O3可作為漂白后布匹“脫氯劑”,Na2S2O3和Cl2反應的產物是H2SO4、NaCl和HCl,則還原劑與氧化劑物質的量之比為 。
查看答案和解析>>
科目: 來源:2014年高考化學蘇教版總復習 1-4 氧化還原反應練習卷(解析版) 題型:填空題
化學實驗的微型化可有效減少污染,實現(xiàn)化學實驗綠色化的要求。某學生按下列操作做一個實驗:在一塊下襯白紙的玻璃片的不同位置分別滴加濃度為0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每種液滴彼此分開,圍成半徑小于表面皿的圓形(如圖所示),在圓心處放置2粒芝麻粒大小的KMnO4晶體,向KMnO4晶體中滴加一滴濃鹽酸,再立即將表面皿蓋好。[已知:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O]
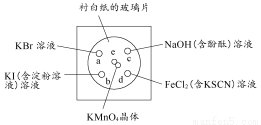
(1)e處反應的離子方程式為 ,該反應中發(fā)生反應的氧化劑和還原劑的物質的量之比為 。
(2)b處的實驗現(xiàn)象為 ,d處的實驗現(xiàn)象為 。
(3)c處反應的化學方程式為 ,標準狀況下,當有0.224 L Cl2被NaOH溶液吸收后,轉移電子的物質的量為 mol。
(4)通過該實驗能否比較Cl2、FeCl3、KMnO4三種物質氧化性的強弱? (填“能”或“不能”),若能,其氧化性由強到弱的順序是 。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com