
科目: 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:選擇題
如圖是NaCl、MgSO4的溶解度曲線。下列說法正確的是 ( )

A.只有在t1 ℃時,NaCl和MgSO4的溶解度才相等
B.t1~t2 ℃,MgSO4的溶解度隨溫度升高而減小
C.在t2 ℃時,MgSO4飽和溶液的溶質質量分數最大
D.把MgSO4飽和溶液的溫度從t3 ℃降至t2 ℃時,有晶體析出
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:選擇題
36.5 g HCl溶解在1 L水中(水的密度近似為1 g·mL-1),所得溶液的密度為ρ g·mL-1,質量分數為W,物質的量濃度為c mol·L-1,NA表示阿伏加德羅常數,則下列敘述中正確的是( )
A.所得溶液的物質的量濃度:c=1 mol·L-1
B.所得溶液中含有NA個HCl分子
C.36.5 g HCl氣體占有的體積為22.4 L
D.所得溶液的質量分數:W=36.5 c/(1 000ρ)
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:計算題
試回答下列問題。
(1)已知24 g A和40 g B恰好完全反應生成0.4 mol C和32 g D,則C的摩爾質量為________。
(2)把1 mol Na和1 mol Mg分別投入到等量且過量的鹽酸中,分別得到溶液a和b,則溶液a和b的質量關系為ma________mb。
(3)如圖為實驗室某濃鹽酸試劑瓶的標簽上的有關數據,試根據標簽上的有關數據回答下列問題:

①該濃鹽酸中HCl的物質的量濃度為______ mol·L-1。
②標準狀況下,1.00 L水(密度為1.00 g·cm-3)吸收________ L的HCl可制得上述濃鹽酸。
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:實驗題
奶粉中蛋白質含量的測定往往采用“凱氏定氮法”,其原理是食品與硫酸和催化劑一同加熱,使蛋白質分解,分解的氨與硫酸結合生成硫酸銨。然后堿化蒸餾使氨游離,用硼酸吸收后再以硫酸或鹽酸標準溶液滴定,根據酸的消耗量乘以換算系數,即為蛋白質含量。
操作步驟:
①樣品處理:準確稱取一定量的固體樣品奶粉,移入干燥的燒杯中,經過一系列的處理,待冷卻后移入一定體積的容量瓶中。
②NH3的蒸餾和吸收:把制得的溶液(取一定量),通過定氮裝置,經過一系列的反應,使氨變成硫酸銨,再經過堿化蒸餾后,氨即成為游離態,游離氨經硼酸吸收。
③氨的滴定:用標準鹽酸溶液滴定所生成的硼酸銨,由消耗的鹽酸標準液計算出總氮量,再折算為粗蛋白含量。
試回答下列問題:
(1)在樣品的處理過程中使用到了容量瓶,怎樣檢查容量瓶是否漏水?
________________________________________________________________________________________________________________________________________________。
(2)在配制過程中,下列哪項操作可能使配制的溶液的濃度偏大( )
A.燒杯中溶液轉移到容量瓶中時,未洗滌燒杯
B.定容時,俯視刻度線
C.定容時,仰視刻度線
D.移液時,有少量液體濺出
(3)若稱取樣品的質量為1.5 g,共配制100 mL的溶液,取其中的20 mL,經過一系列處理后,使N轉變為硼酸銨然后用0.1 mol·L-1鹽酸滴定,其用去鹽酸的體積為23.0 mL,則該樣品中N的含量為________。
[已知:滴定過程中涉及到的反應方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:填空題
鹽泥是氯堿工業中的廢渣,主要成分是鎂的硅酸鹽和碳酸鹽(含少量鐵、鋁、鈣的鹽)。實驗室以鹽泥為原料制取MgSO4·7H2O的實驗過程如下:
―→―→產品
已知:①室溫下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+從開始沉淀到沉淀完全的pH范圍依次為7.1~9.6、2.0~3.7、3.1~4.7。③三種化合物的溶解度(S)隨溫度變化的曲線如圖所示。

(1)在鹽泥中加入稀硫酸調pH為1~2以及煮沸的目的是_____________________。
(2)若室溫下的溶液中Mg2+的濃度為6.0 mol·L-1,則溶液pH≥________才可能產生Mg(OH)2沉淀。
(3)由濾液Ⅰ到濾液Ⅱ需先加入NaClO調溶液pH約為5,再趁熱過濾,則趁熱過濾的目的是__________________,濾渣的主要成分是______________________。
(4)從濾液Ⅱ中獲得MgSO4·7H2O晶體的實驗步驟依次為①向濾液Ⅱ中加入______________;②過濾,得沉淀;③________________;④蒸發濃縮,降溫結晶;⑤過濾、洗滌得產品。
(5)若獲得的MgSO4·7H2O的質量為24.6 g,則該鹽泥中鎂[以Mg(OH)2計]的百分含量約為________(MgSO4·7H2O的相對分子質量為246)。
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:填空題
已知硫酸、氨水的密度與所加水的量的關系如圖所示,現有硫酸與氨水各一份,請根據表中信息,回答下列問題:
| 溶質的物質的量 濃度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |

(1)表中硫酸的質量分數為________(不寫單位,用含c1、ρ1的代數式表示)。
(2)物質的量濃度為c1 mol·L-1的硫酸與水等體積混合(混合后溶液的體積變化忽略不計),所得溶液的物質的量濃度為________ mol·L-1。
(3)將物質的量濃度分別為c2 mol·L-1和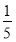 c2 mol·L-1的氨水等質量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物質的量濃度________
c2 mol·L-1的氨水等質量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物質的量濃度________ 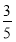 c2 mol·L-1(設混合后溶液的體積變化忽略不計)。
c2 mol·L-1(設混合后溶液的體積變化忽略不計)。
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題九化學反應速率化學平衡練習卷(解析版) 題型:選擇題
反應N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化的曲線如圖所示。下列說法正確的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化的曲線如圖所示。下列說法正確的是( )

A.a、c兩點的反應速率:a>c
B.a、c兩點氣體的顏色:a深、c淺
C.a、b兩點氣體的平均相對分子質量:a>b
D.b、c兩點化學平衡常數:b<c
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題九化學反應速率化學平衡練習卷(解析版) 題型:選擇題
在容積恒定的密閉容器中,一定量的SO2與1.1 mol O2發生反應:2SO2(g)+O2(g)  2SO3(g) ΔH<0。當氣體的物質的量減少0.315 mol時,反應達到平衡,SO2的平衡轉化率是90%。下列說法正確的是( )
2SO3(g) ΔH<0。當氣體的物質的量減少0.315 mol時,反應達到平衡,SO2的平衡轉化率是90%。下列說法正確的是( )
A.相同條件下,平衡時若充入稀有氣體,SO2的轉化率增大
B.反應開始時,向容器中通入的SO2的物質的量是0.7 mol
C.保持其他條件不變,僅降低溫度,正反應速率減小程度比逆反應速率減小程度大
D.保持其他條件不變,僅縮小容器體積,反應達到平衡時容器中有1.485 mol氣體
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題九化學反應速率化學平衡練習卷(解析版) 題型:選擇題
下列表格中的各種情況,可以用如圖所示曲線表示的是( )

選項反應縱坐標甲乙
A相同質量的氨氣,在同一容器中發生反應:2NH3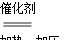 N2+3H2氨氣的轉化率500 ℃400 ℃
N2+3H2氨氣的轉化率500 ℃400 ℃
B等質量的鉀、鈉分別與足量的水反應H2的質量鈉鉀
C在體積可變的恒壓容器中,體積之比為1∶3的N2、H2:N2+3H2 2NH3氨氣的濃度活性高的催化劑 活性一般的催化劑
2NH3氨氣的濃度活性高的催化劑 活性一般的催化劑
D2 mol SO2和1 mol O2在相同溫度下發生反應:2SO2+O2 2SO3SO3的物質的量2個大氣壓 10個大氣壓
2SO3SO3的物質的量2個大氣壓 10個大氣壓
查看答案和解析>>
科目: 來源:2014高考化學二輪專題突破 專題九化學反應速率化學平衡練習卷(解析版) 題型:選擇題
一定溫度時,向2.0 L恒容密閉容器中充入2 mol SO2和1 mol O2,發生反應:
2SO2(g)+O2(g)  2SO3(g)。經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
2SO3(g)。經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列說法正確的是( )
A.反應在前t1s的平均速率v(O2)=0.4/t1 mol·L-1·s-1
B.保持其他條件不變,體積壓縮到1.0 L,平衡常數將增大
C.相同溫度下,起始時向容器中充入4 mol SO3,達到平衡時,SO3的轉化率大于10%
D.保持溫度不變,向該容器中再充入2 mol SO2、1 mol O2,反應達到新平衡時n(SO3)/n(O2)增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com