
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:選擇題
在以下的分子或離子中,空間結構的幾何形狀不是三角錐形的是( )
A.NF3 B.CH3— C.BF3 D.H3O+
查看答案和解析>>
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:選擇題
PH3是一種無色劇毒氣體,其分子結構和NH3相似,但P-H鍵鍵能比N-H鍵鍵能低。下列判斷中錯誤的是( )
A.PH3分子呈三角錐形
B.PH3分子是極性分子
C.PH3沸點低于NH3沸點,因為P—H鍵鍵能低
D.PH3分子穩定性低于NH3分子,因為N—H鍵鍵能高
查看答案和解析>>
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:選擇題
下列物質的熔、沸點高低順序中排列正確的是 ( )
A.金剛石>晶體硅>碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>O2>N2>H2O D.金剛石>生鐵>純鐵>鈉
查看答案和解析>>
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:選擇題
美國LawreceLiremore國家實驗室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高壓下將CO2轉化為具有類似SiO2結構的原子晶體,下列關于CO2的原子晶體說法中正確的是( )
A.CO2的原子晶體中存在范德華力,每1 mol CO2原子晶體中含有2NAπ鍵
B.在一定條件下,CO2原子晶體轉化為CO2分子晶體是物理變化
C.熔點:金剛石>原子晶體CO2
D.在CO2的原子晶體中,每個C原子周圍結合4個O原子,每個O原子與兩個C原子相結合
查看答案和解析>>
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:填空題
圖表法、圖像法是常用的科學研究方法。
Ⅰ.圖(A)是短周期某主族元素X的電離能所示情況。則X元素位于周期表的第 族。
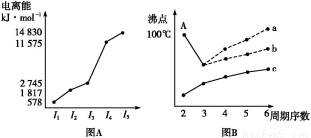
圖B是研究部分元素的氫化物的沸點變化規律的圖像,折線c可以表達出第 族元素氫化物的沸點的變化規律。
Ⅱ.下表是元素周期表的一部分,表中所列的字母分別代表一種化學元素。
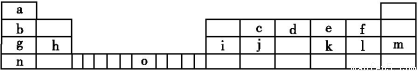
試回答下列問題:
(1)請寫出元素o的外圍電子排布式: 。
(2)由j原子跟c原子以1∶1相互交替結合而形成的晶體,晶型與晶體j相同。兩者相比熔點更高的是
(填化學式),試從結構角度加以解釋:
(3)i單質晶體中原子的堆積方式如下圖甲所示,其晶胞特征如下圖乙所示,原子之間相互位置關系的平面圖如下圖丙所示。
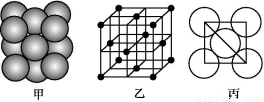
請回答:晶胞中i原子的配位數為 ,一個晶胞中i原子的數目為 。
查看答案和解析>>
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:選擇題
下列敘述中正確的是( )
A.分子晶體中都存在共價鍵
B.F2、Cl2、Br2、I2的熔、沸點逐漸升高與分子間作用力有關
C.含有極性鍵的化合物分子一定不含非極性鍵
D.只要是離子化合物,其熔點一定比共價化合物的熔點高
查看答案和解析>>
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:填空題
元素H、C、N、O、F都是重要的非金屬元素,Fe、Cu是應用非常廣泛的金屬。
(1)Fe元素基態原子的核外電子排布式為 。
(2)C、H元素形成的化合物分子中共有16個電子,該分子中σ鍵與π鍵的個數比為
(3)C、N、O三種元素的第一電離能由大到小的順序為(用元素符號表示)
(4)在測定HF的相對分子質量時,實驗測得值一般高于理論值,其主要原因是
(5)C、N兩元素形成的化合物C3N4形成的原子晶體,結構類似金剛石,甚至硬度超過金剛石,其原因是
(6)如圖為石墨晶胞結構示意圖,該晶胞中含有碳原子的個數為
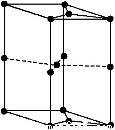
查看答案和解析>>
科目: 來源:2014高考化學名師知識點精編 選修3物質結構與性質練習卷(解析版) 題型:填空題
Ⅰ.金屬鎳及其化合物在合金材料以及催化劑等方面應用廣泛。
(1)基態鎳原子的價電子(外圍電子)排布式為 。
(2)金屬鎳能與CO形成配合物Ni(CO)4,寫出與CO互為等電子體的一種分子和一種離子的化學式 、 。
(3)很多不飽和有機物在Ni催化下可與H2發生加成反應。
如①CH2 CH2、②HC≡CH、③
CH2、②HC≡CH、③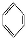 、④HCHO,其中碳原子采取sp2雜化的分子有 (填物質序號),HCHO分子的立體結構為 形。
、④HCHO,其中碳原子采取sp2雜化的分子有 (填物質序號),HCHO分子的立體結構為 形。
(4)Ni2+和Fe2+的半徑分別為69 pm和78 pm,則熔點NiO FeO(填“<”或“>”)。
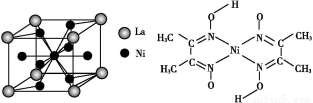
(5)金屬鎳與鑭(La)形成的合金是一種良好的儲氫材料,其晶胞結構示意圖如左下圖所示。該合金的化學式為 。
(6)丁二酮肟常用于檢驗Ni2+:在稀氨水中,丁二酮肟與Ni2+反應生成鮮紅色沉淀,其結構如右下圖所示。該結構中,除共價鍵外還存在配位鍵和氫鍵,請在圖中用箭頭和“…”表示出配位鍵和氫鍵。
查看答案和解析>>
科目: 來源:2014高考化學名師綜合題專練 化學反應原理練習卷(解析版) 題型:填空題
恒溫恒容條件下,硫可以發生如下轉化,其反應過程和能量關系如圖1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-196.6 kJ/mol。
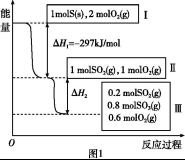
請回答下列問題:
(1)寫出能表示硫的燃燒熱的熱化學方程式: 。
(2)ΔH2= 。
(3)恒溫恒容時,1 mol SO2和2 mol O2充分反應,放出熱量的數值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)將Ⅲ中的混合氣體通入足量的NaOH溶液中消耗NaOH的物質的量為 ,若溶液中發生了氧化還原反應,則該過程的離子方程式為 。
(5)恒容條件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
a.升高溫度
b.充入He氣
c.再充入1 mol SO2(g)和1 mol O2(g)
d.使用催化劑
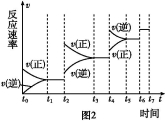
(6)某SO2(g)和O2 (g)體系,時間t1達到平衡后,改變某一外界條件,反應速率v與時間t的關系如圖2所示,若不改變SO2(g)和O2 (g)的量,則圖中t4時引起平衡移動的條件可能是 ;圖中表示平衡混合物中SO3的含量最高的一段時間是 。
查看答案和解析>>
科目: 來源:2014高考化學名師綜合題專練 化學反應原理練習卷(解析版) 題型:填空題
煤化工是以煤為原料,經過化學加工使煤轉化為氣體、液體、固體燃料以及各種化工產品的工業過程。
(1)已知在25 ℃、101 kPa時,C(s)、H2(g)和CO(g)燃燒的熱化學方程式分別為:
C(s)+O2(g)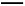 CO2(g) ΔH1=-393.5 kJ/mol;
CO2(g) ΔH1=-393.5 kJ/mol;
H2(g)+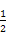 O2(g)
O2(g)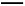 H2O(g) ΔH2=-241.8 kJ/mol;
H2O(g) ΔH2=-241.8 kJ/mol;
CO(g)+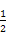 O2(g)
O2(g) CO2(g) ΔH3=-283.0 kJ/mol;
CO2(g) ΔH3=-283.0 kJ/mol;
①則C(s)+H2O(g) CO(g)+H2(g) ΔH= ,該反應平衡常數的表達式為K= ;升高溫度,則K值 (填“變大”、“變小”或“不變”)。
CO(g)+H2(g) ΔH= ,該反應平衡常數的表達式為K= ;升高溫度,則K值 (填“變大”、“變小”或“不變”)。
②如果①反應在容積不變的密閉容器中進行,當反應達到平衡時 (填編號)。
a.v正(CO)∶v逆(H2)=1∶1
b.碳的質量保持不變
c.v正(CO)=v逆(H2O)
d.容器中的壓強不變
③在容積不變的密閉容器中進行①反應,可以使c(CO)增大的是 。
a.升高溫度
b.充入He(g),使體系壓強增大
c.將H2(g)從體系中分離出來
d.加入催化劑
(2)將不同量的CO(g)和H2O(g)分別通入體積為2 L的恒容密閉容器中,進行反應CO(g)+H2O(g) CO2(g)+H2(g),得到如下2組數據:
CO2(g)+H2(g),得到如下2組數據:
實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所 需時間/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①實驗1中以v(CO2)表示的反應速率為 。
②向實驗2的平衡混合物中再加入0.4 mol H2O(g)和0.4 mol CO2,達到新平衡時CO的轉化率 (填“變大”、“變小”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com